
题目列表(包括答案和解析)
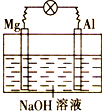 将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是( )
将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是( )将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是
 A. 镁比铝活泼,镁失去电子被氧化成Mg2+
A. 镁比铝活泼,镁失去电子被氧化成Mg2+
B. 铝是电池负极,开始工作时溶液中会立即有白色沉淀生成
C. 该装置的内、外电路中,均是电子的定向移动形成电流
D. 该装置开始工作时,铝片表面的氧化膜可不必处理
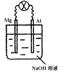 将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是
将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是
A. 镁比铝活泼,镁失去电子被氧化成Mg2+
B. 铝是电池负极,开始工作时溶液中会立即有白色沉淀生成
C. 该装置的内、外电路中,均是电子的定向移动形成电流
D. 该装置开始工作时,铝片表面的氧化膜可不必处理
将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是
 A. 镁比铝活泼,镁失去电子被氧化成Mg2+
A. 镁比铝活泼,镁失去电子被氧化成Mg2+
B. 铝是电池负极,开始工作时溶液中会立即有白色沉淀生成
C. 该装置的内、外电路中,均是电子的定向移动形成电流
D. 该装置开始工作时,铝片表面的氧化膜可不必处理
将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,如图所示,该装置在工作时,下列叙述正确的是( )
A.镁比铝活泼,因此镁电极作电源负极
B.铝是电池负极,其电极反应式为Al-3e- +3OH-=Al(OH)3
C.该装置的内、外电路中,均是电子的定向移动形成电流
D.该装置开始工作时,铝片表面的氧化膜不必处理
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com