
题目列表(包括答案和解析)
工业上镀铬废液中,含有剧毒的Cr2O72—,通常用FeSO4将其还原成毒性微小的Cr3+,反应是在pH<7的条件下进行的,写出上述反应的离子方程式。
?????____________________________________________
下列说法正确的是( )
A.常温下,在pH<7的酸性溶液中,不可能存在NH3?H2O
B.常温下.在pH=7的NH4Cl和NH3?H2O的混合液中。c(NH4+)=(Cl-)
C.将等物质的量的NH4Cl和NH3?H2O溶于水配成溶液.则溶液中c(NH4+)<(Cl-)
D.在0.1moL/L的K2S溶液中:c(K+)=c(S2-)+c(HS-)+c(H2S)
下列各组离子,在指定环境中能大量共存的是( )
A、常温下,在PH=1的溶液:Cu2+、Na+、Mg2+、NO3-
B、常温下,在滴加酚酞试液显红色的溶液:K+、HCO3-、Br-、Ba2+
C、常温下,在PH<7的溶液中, Fe3+ 、 Cu2+ 、 Cl- 、 NO3-
D、常温下,在含有大量Ba(NO3)2的溶液中:Mg2+、NH4+、SO42-、Cl-
下列说法正确的是( )
A.pH<7的溶液一定是酸性溶液
B.pH=5的溶液和pH=3的溶液相比,前者C(OH-)是后者的100倍
C.室温下,每1×107个水分子中只有1个水分子发生电离
D.在1 mol·L-1的氨水中,改变外界条件使C(![]() )增大,则溶液的pH一定增大
)增大,则溶液的pH一定增大
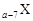 、
、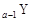 、
、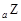 、
、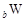 、
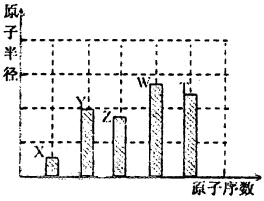
、 是五种常见的短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的元素。W原子最外层电子数是K层电子数的2倍。
是五种常见的短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的元素。W原子最外层电子数是K层电子数的2倍。
(l)W在周期表中的位置为_______________________。
(2)Y、Z的10电子氢化物分子中均含有的化学键类型为___________;其稳定性较强的是___________
(填化学式)。
(3)用化学方程式表示YZ2形成酸雨的反应:______________________。
用精密pH试纸(精确到0.l)测定酸雨pH的操作是______________________。
(4)常温下用1 mol/L100 mL NaOH溶液恰好完全吸收0.1molTZ2气体,此反应的离子方程式为
______________________;此时溶液pH<7的原因是___________________________。
(5)在25℃、101kPa下,己知W与X形成的气态化合物与足量Z2点燃完全反应(生成W的最高价
化合物),恢复至原状态,平均每转移l mol e_放热190 kJ,该反应的热化学方程式为___________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com