
题目列表(包括答案和解析)

| ||
| ||
| 密度 | 熔点 | 沸点 | |
| 四氯化锡 | 2.2g?cm-3 | -33℃ | 114℃ |
| 金属锡 | 5.77g?cm-3 | 231℃ |

硫酸亚锡(SnSO4)、四氯化锡(SnCl4)常用于印染和电镀工业。
(1)某研究小组设计SnSO4制备路线如下:

已知:酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化;SnCl2极易水解。
①SnCl2酸溶后加入Sn粉的作用是??????????????????????? 。
②步骤Ⅱ中用到的玻璃仪器除烧杯外还有????????????? ;步骤Ⅳ中需要洗涤固体SnO中含有的杂质,检验SnO中的Cl-是否洗涤干净的操作为???????????????? 。
③步骤Ⅴ涉及到的操作有:a.过滤? b.洗涤? c.蒸发浓缩? d.冷却结晶? e.低温干燥,则其正确的操作顺序为??????????????????????? 。
(2)实验室拟用以下装置,用熔融的金属锡与干燥纯净的氯气制取无水SnCl4(SnCl4熔点-33℃,沸点114.1℃,遇潮湿空气极易水解),此反应过程放出大量的热。
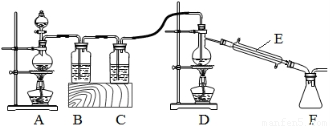
①装置C中应加入试剂为___________;仪器E的名称为____________________。
②反应开始生成SnCl4时,可以先熄灭___(填字母序号)处的酒精灯,理由是________。
③该实验装置设计尚存在缺陷,改进的方法是(包括仪器、试剂及连接位置等)______________。
(18分)锡是一种银白色而又柔软的金属, 2000年前人类就已开始使用锡。金属锡为排列在白金,黄金及银后面的第四种贵金属,它富有光泽、无毒、不易氧化变色,具有很好的杀菌、净化、保鲜效用。生活中常用于食品保鲜、罐头内层的防腐膜等。请回答下列有关锡的问题:
(1)锡在自然界几乎都以锡石的形式存在,此外还有极少量的锡的硫化物矿。以锡石(SnO2)为原料,用足量的焦炭作还原剂,在高温下可制得粗锡,该反应的化学方程式为 ,粗锡经电解精炼可得纯锡,精炼时的阴极反应式为____________。
(2)锡的氯化物有SnCl2和SnCl4。SnCl2是生产和化学实验中常用的还原剂,易发生水解;SnCl4常温下是无色液体,在空气中极易水解,熔点—36℃,沸点114℃。
Ⅰ.若实验室中以SnCl2固体配制SnCl2溶液,试简述操作方法 。
Ⅱ.某实验小组拟利用下图中的仪器,设计组装一套实验装置,用熔融的金属锡与干燥的氯气直接作用制取无水四氯化锡(此反应过程放出大量的热),已知金属锡的熔点为231℃。请回答下列各问题:
①用玻管(未画出)连接上述装置,正确的顺序是(填各接口的代码字母)____接____、____接____、____接____、____接____、____接____。
②装置Ⅵ的作用是___________;装置Ⅳ的作用是___________。
③冷凝管里冷却水的流向是从___________进入,从___________流出。
④试验时点燃Ⅰ处酒精灯,加热温度应大于 ℃,待 即可停止加热。
⑤如果将制取的四氯化锡少许暴露于空气中,预期可看到的现象是_______________。
⑥该实验装置中还存在的一个问题是 。
(18分)锡是一种银白色而又柔软的金属, 2000年前人类就已开始使用锡。金属锡为排列在白金,黄金及银后面的第四种贵金属,它富有光泽、无毒、不易氧化变色,具有很好的杀菌、净化、保鲜效用。生活中常用于食品保鲜、罐头内层的防腐膜等。请回答下列有关锡的问题:
(1)锡在自然界几乎都以锡石的形式存在,此外还有极少量的锡的硫化物矿。以锡石(SnO2)为原料,用足量的焦炭作还原剂,在高温下可制得粗锡,该反应的化学方程式为 ,粗锡经电解精炼可得纯锡,精炼时的阴极反应式为____________。
(2)锡的氯化物有SnCl2和SnCl4。SnCl2是生产和化学实验中常用的还原剂,易发生水解;SnCl4常温下是无色液体,在空气中极易水解,熔点—36℃,沸点114℃。
Ⅰ.若实验室中以SnCl2固体配制SnCl2溶液,试简述操作方法 。
Ⅱ.某实验小组拟利用下图中的仪器,设计组装一套实验装置,用熔融的金属锡与干燥的氯气直接作用制取无水四氯化锡(此反应过程放出大量的热),已知金属锡的熔点为231℃。请回答下列各问题:

①用玻管(未画出)连接上述装置,正确的顺序是(填各接口的代码字母)____接____、____接____、____接____、____接____、____接____。
②装置Ⅵ的作用是___________;装置Ⅳ的作用是___________。
③冷凝管里冷却水的流向是从___________进入,从___________流出。
④试验时点燃Ⅰ处酒精灯,加热温度应大于 ℃,待 即可停止加热。
⑤如果将制取的四氯化锡少许暴露于空气中,预期可看到的现象是_______________。
⑥该实验装置中还存在的一个问题是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com