
题目列表(包括答案和解析)
葡萄糖酸锌[(C6H11O6O)2Zn]是一种营养锌强化剂,对婴儿及青少年的智力和身体发育有重要作用。工业上通过如下两步制备:
(1)步骤一:充分反应后,过滤除去CaSO4沉淀。设计一个简单的实验,检验产物葡萄糖酸溶液中是否含有SO42—: 。
(2)步骤二:将葡萄糖酸溶液与ZnO混合,使其充分反应后,继续加入葡萄糖酸溶液至pH为5.8,其目的是 ,下列物质可替代ZnO的是 (填字母)。
a.NH3·H2O b.Zn(OH)2 c.NaOH d.ZnSO4
(3)将最后所得溶液浓缩至原来体积的 ,加入适量无水乙醇,放置8h以上,经结晶、分离、干燥获得葡萄糖酸锌晶体。分离过程中加入无水乙醇的目的是 。
,加入适量无水乙醇,放置8h以上,经结晶、分离、干燥获得葡萄糖酸锌晶体。分离过程中加入无水乙醇的目的是 。
(4)下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1. 1 | 3. 2 |
| Fe2+ | 5. 8 | 8. 8 |
| Cu2+ | 5. 2 | 6. 4 |
(15分)蓝铜矿主要含2CuCO3·Cu(OH)2,还含有少量Fe、Si的化合物,工业上以蓝铜矿为原料制备Cu及CaCO3,方法有多种。
(1)蓝铜矿与焦炭加热可以生成铜、二氧化碳和水,写出该反应的化学方程式。______________________________________________________________。
具体方法步骤如下:
请回答下列问题:
(2)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:检验溶液A中含有Fe2+的最佳试剂为 (填代号),实验步骤中试剂①为 (填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(3)由溶液C获得CuSO4·5H2O,需要经过加热蒸发,冷却结晶、过滤等操作,加热蒸发至 ___________________时停止加热。玻璃棒在整个操作中的作用是 ________________ 。
(4)制备CaCO3时,应向CaCl2溶液中先通入(或先加入) (填化学式)。若实验过程中有氨气逸出、应选用下列 装置吸收尾气(填代号)。
(5)从溶液C中获得Cu的方法有 (写出两种不同方法)。
(6)用惰性电极电解硫酸铜溶液一段时间后,加入2molCu(OH)2固体使硫酸铜溶液复原(复原是指溶液溶质成分及浓度与原来完全相同),则此电解过程中共转移电子 mol。
(15分)蓝铜矿主要含2CuCO3·Cu(OH)2,还含有少量Fe、Si的化合物,工业上以蓝铜矿为原料制备Cu及CaCO3,方法有多种。
(1)蓝铜矿与焦炭加热可以生成铜、二氧化碳和水,写出该反应的化学方程式。______________________________________________________________。
具体方法步骤如下: 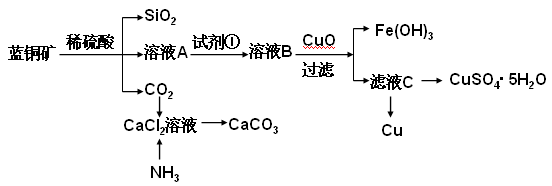
请回答下列问题:
(2)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:检验溶液A中含有Fe2+的最佳试剂为 (填代号),实验步骤中试剂①为 (填代号)。
a.KMnO4 b.(NH4) 2S c.H2O2 d.KSCN
(3)由溶液C获得CuSO4·5H2O,需要经过加热蒸发,冷却结晶、过滤等操作,加热蒸发至 ___________________时停止加热。玻璃棒在整个操作中的作用是 ________________ 。
(4)制备CaCO3时,应向CaCl2溶液中先通入(或先加入) (填化学式)。若实验过程中有氨气逸出、应选用下列 装置吸收尾气(填代号)。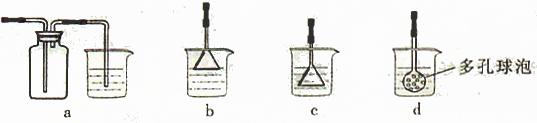
(5)从溶液C中获得Cu的方法有 (写出两种不同方法)。
(6)用惰性电极电解硫酸铜溶液一段时间后,加入2molCu(OH)2固体使硫酸铜溶液复原(复原是指溶液溶质成分及浓度与原来完全相同),则此电解过程中共转移电子 mol。
(15分)蓝铜矿主要含2CuCO3·Cu(OH)2,还含有少量Fe、Si的化合物,工业上以蓝铜矿为原料制备Cu及CaCO3,方法有多种。
(1)蓝铜矿与焦炭加热可以生成铜、二氧化碳和水,写出该反应的化学方程式。______________________________________________________________。
具体方法步骤如下:

请回答下列问题:
(2)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:检验溶液A中含有Fe2+的最佳试剂为 (填代号),实验步骤中试剂①为 (填代号)。
a.KMnO4 b.(NH4) 2S c.H2O2 d.KSCN
(3)由溶液C获得CuSO4·5H2O,需要经过加热蒸发,冷却结晶、过滤等操作,加热蒸发至 ___________________时停止加热。玻璃棒在整个操作中的作用是 ________________ 。
(4)制备CaCO3时,应向CaCl2溶液中先通入(或先加入) (填化学式)。若实验过程中有氨气逸出、应选用下列 装置吸收尾气(填代号)。
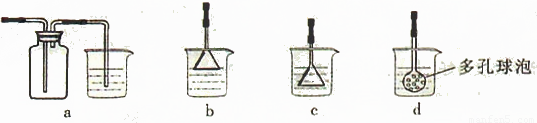
(5)从溶液C中获得Cu的方法有 (写出两种不同方法)。
(6)用惰性电极电解硫酸铜溶液一段时间后,加入2molCu(OH)2固体使硫酸铜溶液复原(复原是指溶液溶质成分及浓度与原来完全相同),则此电解过程中共转移电子 mol。
蓝铜矿主要含2CuCO3·Cu(OH)2,还含有少量Fe、Si的化合物,工业上以蓝铜矿为原料制备Cu及CaCO3,方法有多种。
(1)蓝铜矿与焦炭加热可以生成铜、二氧化碳和水,写出该反应的化学方程式。______________________________________________________________。
具体方法步骤如下:

请回答下列问题:
(2)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:检验溶液A中含有Fe2+的最佳试剂为 (填代号),实验步骤中试剂①为 (填代号)。
a.KMnO4 b.(NH4) 2S c.H2O2 d.KSCN
(3)由溶液C获得CuSO4·5H2O,需要经过加热蒸发,冷却结晶、过滤等操作,加热蒸发至 ___________________时停止加热。玻璃棒在整个操作中的作用是 ________________ 。
(4)制备CaCO3时,应向CaCl2溶液中先通入(或先加入) (填化学式)。若实验过程中有氨气逸出、应选用下列 装置吸收尾气(填代号)。
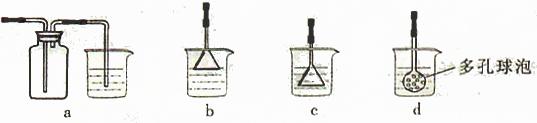
(5)从溶液C中获得Cu的方法有 (写出两种不同方法)。
(6)用惰性电极电解硫酸铜溶液一段时间后,加入2molCu(OH)2固体使硫酸铜溶液复原(复原是指溶液溶质成分及浓度与原来完全相同),则此电解过程中共转移电子 mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com