
(2012?长宁区二模)三草酸合铁酸钾晶体(K
3[Fe(C
2O
4)
3]?xH
2O)是一种光敏材料,可用于摄影和蓝色印刷.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1)查资料得该晶体在110℃可完全失去结晶水.于是将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;恒温在110℃一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量.请纠正实验过程中的两处错误:
加热后没有在干燥器中冷却
加热后没有在干燥器中冷却
,
晶体加热后,没有进行恒重操作
晶体加热后,没有进行恒重操作
.
(2)已知2KMnO
4+5H
2C
2O
4+3H
2SO
4→K
2SO
4+10CO
2↑+2MnSO
4+8H
2O,现称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液,取所配溶液25.00ml于锥形瓶中,加稀H
2SO
4酸化,滴加KMnO
4溶液至草酸根恰好全部被氧化成二氧化碳.向反应后的溶液中加入一小匙锌粉,加热至浅黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性.加入锌粉的目的是
将Fe3+还原成Fe2+,为进一步测定铁元素的含量做准备
将Fe3+还原成Fe2+,为进一步测定铁元素的含量做准备
.
(3)用0.010mol/L KMnO
4溶液滴定上一步骤所得溶液至终点,消耗KMnO
4溶液20.02ml,滴定中MnO
4-被还原成Mn
2+.写出发生反应的离子方程式
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
.
(4)上述实验滴定时,指示剂应该
不加
不加
(填“加”或“不加”),如何判断滴定终点:
当待测液中出现紫红色,且振荡后半分钟内不再褪色,就表明到了终点
当待测液中出现紫红色,且振荡后半分钟内不再褪色,就表明到了终点
.
(5)在(2)题步骤中,若加入的KMnO
4的溶液的量不足,可导致测得的铁含量
偏高
偏高
.(选填“偏低”“偏高”“不变”)
(6)重复(2)(3)步骤操作,滴定消耗0.010mol/L KMnO
4溶液19.98ml.则实验测得该晶体中铁的质量分数为
11.12%
11.12%
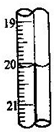
.若蓝色手柄滴定管滴定后读数如右图所示,则以下记录的数据正确的是
A
A
A.20.00mL B.20.0mL C.20.10mL D.20.1mL.

 三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?xH2O)是一种光敏材料,可用于摄影和蓝色印刷.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?xH2O)是一种光敏材料,可用于摄影和蓝色印刷.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验: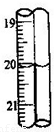
 (2012?长宁区二模)三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?xH2O)是一种光敏材料,可用于摄影和蓝色印刷.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(2012?长宁区二模)三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?xH2O)是一种光敏材料,可用于摄影和蓝色印刷.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验: