
题目列表(包括答案和解析)
用已知浓度的强碱溶液滴定未知浓度的某强酸溶液时,下列操作不会引起酸液浓度的测定值出现偏差的是( )
A.将移液管里下端残液吹入锥形瓶;
B.滴定时向锥形瓶中加入少量的蒸馏水后继续滴定;
C.滴定管用蒸馏水洗涤后未用标准碱液润洗就装入标准碱液进行滴定;
D.用甲基橙作指示剂。
酸碱中和反应是中学化学一类重要的反应,其反应的本质都是H+和OH-反应生成H2O.某学生实验小组对课本中的两个酸碱中和实验进行了模拟研究.
(1)用下图装置进行强酸(50 mL 0.5 mol/L的HCI)和强碱(50 mL 0.55 mol/L的NaOH)反应的中和热测定.
①从实验装置上看,图中尚缺少的一种玻璃仪器是________;
②大小烧杯之间填满纸屑的作用是________;
③向组装好的量热器中加入50 mL盐酸并测定温度,取出温度计并冲
净后,再将已测定好温度的NaOH溶液50 mL加入量热器.下列加入50 mL NaOH溶液的操作正确的是________.
A.为了使酸碱充分中和,必须边滴加NaOH溶液边迅速搅拌
B.把50 mL NaOH溶液一次迅速倒入,盖上纸板迅速搅拌.
④若用醋酸代替上述盐酸实验,实验测得的中和热值________(填偏大、偏小或无影响).
(1)、用实验室准确配制的0.100 mol/L的NaOH溶液测定某未知浓度的稀盐酸.
其具体实验步骤如下:
①取一支碱式滴定管下图中有两只滴定管~上端未画出,你选择哪一只?________(填写对应字母),用少量标准NaOH溶液润洗2~3次水洗后的碱式滴定管,再加入标准的0.100 mol/L的NaOH溶液并记录液面刻度读数;
②用酸式滴定管精确的放出25.00 mL待测盐酸,置于用蒸馏水洗净的锥形瓶中,再加入酚酞(变色范围:8.2~10.0)试液2滴;
③滴定时,边滴边振荡,同进注视眼睛注视锥形瓶内容也颜色的变化,当锥形瓶内溶液由________(填写颜色变化)且半分钟内不褪色时,即达到滴定终点;
④记录液面刻度读数.根据滴定管的两次读数得出消耗标准盐酸的体积,再重复测定两次,实验结果记录见下表:
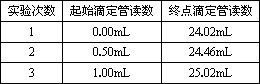
测得未知稀盐酸的物质的量浓度为________(保留小数点后3位).
⑤如果滴定结束时俯视碱式滴定管刻度读数(其它操作均正确),则对滴定结果~稀盐酸浓度的影响是________(填“偏高”、“偏低”或“无影响”).
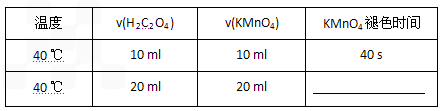
 H++In- 。则酸根离子In 的颜色是_________。甲基橙的酸性与草酸相比,__________(填前者强、前者弱、十分接近、无法判断)。
H++In- 。则酸根离子In 的颜色是_________。甲基橙的酸性与草酸相比,__________(填前者强、前者弱、十分接近、无法判断)。 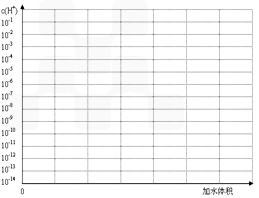

 H++In-。则酸根离子In-的颜色是_____________。甲基橙的酸性与草酸相比,__________(填前者强、前者弱、十分接近、无法判断)。
H++In-。则酸根离子In-的颜色是_____________。甲基橙的酸性与草酸相比,__________(填前者强、前者弱、十分接近、无法判断)。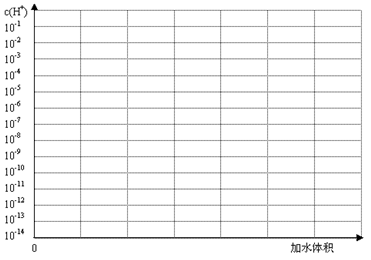
 记录液面刻度的读数;
记录液面刻度的读数; 根据滴定管的两次读数得出NaOH溶液的体积为22mL
根据滴定管的两次读数得出NaOH溶液的体积为22mL| 加入NaOH溶液的体积V/mL | 0.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| 剩余盐酸溶液的体积V/mL | 20.00 | 2.00 | 0.20 | 0.02 | 0.00 | / | / | / | / |
| 过量NaOH溶液的体积V/mL | / | / | / | / | / | 0.02 | 0.20 | 2.00 | 20.00 |
| pH | 1.00 | 2.28 | 3.30 | 7.00 | 9.70 | 11.70 | 12.50 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com