
题目列表(包括答案和解析)
| 实验操作 | 实验现象与结论步骤 |
| 步骤1:用四支试管,各取少量四种溶液,分别滴加紫色石蕊试液. | 一支试管溶液由无色变成红色,则原溶液是 ______.其余三支试管溶液变蓝. |
| 步骤2:另用三支试管,各取少量未确定的三种溶液,分别滴加步骤1检验出的溶液. | 一支试管溶液中有气泡放出,则原溶液是 ______溶液.其余两支试管无明显现象. |
| 步骤3:另用两支试管,各取少量未确定的两种溶液,分别______. | ______反应的化学方程式为______. |
| 同学 | 实验现象 | 结论 |
| 小峰 | 一支试管溶液中有气泡放出,其余两支试管溶液中无现象. | 所滴加的溶液是稀盐酸. |
| 小伟 | 一支试管溶液中有白色沉淀,其余两支试管溶液中无现象 | 所滴加的是Na2CO3溶液. |
| 小明 | 三支试管溶液中都无现象. | 所滴加的是NaOH溶液. |
某学习小组的同学在学习了Na2CO3、NaHCO3的性质后,了解到它们都能与盐酸反应产生CO2气体,那么如何鉴别Na2CO3和NaHCO3呢?带着这样的疑问,他们进行了下列探究:
[查阅资料](1)Ca(HCO3)2可溶于水;
(2)NaHCO3固体受热分解生成碳酸钠、二氧化碳和水.
[猜想](1)甲同学认为可用澄清石灰水鉴别Na2CO3和NaHCO3溶液.
(2)乙同学认为可用CaCl2溶液鉴别Na2CO3和NaHCO3溶液.
甲、乙两同学的猜想是依据澄清石灰水、CaCl2溶液分别与Na2CO3溶液反应均有沉淀产生;又知道Ca(HCO3)2可溶于水,因此猜测澄清石灰水、CaCl2溶液分别与NaHCO3溶液混合不会产生沉淀,从而鉴别出两种溶液.
(3)丙同学认为固体Na2CO3、NaHCO3可用加热的方法鉴别.
[实验探究](1)甲同学在两支分别盛有少量Na2CO3、NaHCO3溶液的试管中,各加入澄清石灰水,观察到两支试管中的现象相同,均产生了白色沉淀,实验结果与猜想不一致,即不能用澄清石灰水鉴别Na2CO3和NaHCO3溶液.
(2)乙同学将CaCl2溶液加入到分别盛有少量Na2CO3、NaHCO3溶液的试管中,发现两支试管中也都产生了白色沉淀,实验结果出乎意料,但根据观察到的其他实验现象,他认为仍可用CaCl2溶液鉴别Na2CO3和NaHCO3溶液.
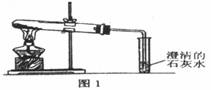
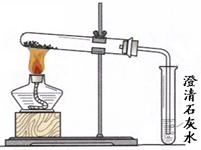
(3)丙同学分别取了一定量的Na2CO3、NaHCO3固体于大试管中加热(如图1):
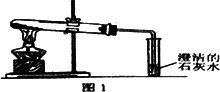
①加热Na2CO3时,开始即见小试管中有少量气泡产生,继续加热,气泡逐渐减少,未见澄清石灰水变浑浊,
②加热NaHCO3时,丙同学观察到实验现象与①不同,证实了自己的猜想是合理的.
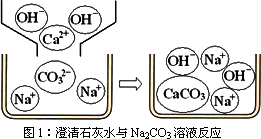
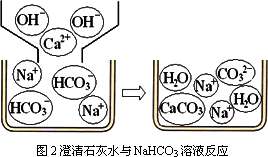
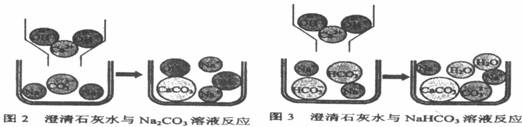
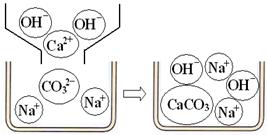
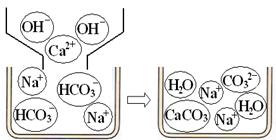
[问题讨论](1)小组同学对上述实验展开了讨论,对甲同学的两个实验进行了比较,并从物质在溶液中解离出不同离子的微观角度分析了原因(如图2、图3).请写出Na2CO3与澄清石灰水发生反应的化学方程式________;写出NaHCO3与澄清石灰水混合时参与反应的离子:________.
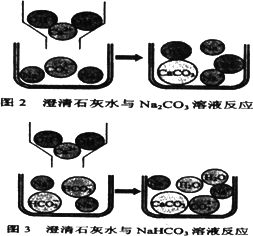
(2)乙同学的两个实验中,大家对CaCl2与Na2CO3溶液的反应比较熟悉,该反应的化学方程式为________;而对CaCl2与NaHCO3溶液混合产生的现象难以理解,同学们又进一步查阅了资料,了解到CaCl2与NaHCO3溶液可发生如下反应:CaCl2+2NaHCO3=CaCO3↓+2NaCl+CO2↑+H2O,因而同学们知道了乙同学是通过观察到________现象来鉴别Na2CO3和NaHCO3溶液的.
至于CaCl2与NaHCO3溶液为什么能发生上述反应,老师指出其反应原理较复杂,有待于今后学习中进一步探究.
(3)丙同学在加热Na2CO3固体时,开始产生少量气泡的原因是________;根据你分析:Na2CO3受热________分解(填“易”或“不易”).在加热NaHCO3固体时,丙同学观察到的实验现象是________(任写一种).
[拓展应用](1)固体Na2CO3中混有少量NaHCO3,可通过________方法除去.
(2)要除去Na2CO3溶液中混有的少量NaHCO3,可加入适量的________溶液.
某学习小组的同学在学习了Na2CO3、NaHCO3的性质后,了解到它们都能与盐酸反应产生CO2气体,那么如何鉴别Na2CO3和NaHCO3呢?带着这样的疑问,他们进行了下列探究:
[查阅资料](1)Ca(HCO3)2可溶于水;
(2)NaHCO3固体受热分解生成碳酸钠、二氧化碳和水.
[猜想](1)甲同学认为可用澄清石灰水鉴别Na2CO3和NaHCO3溶液.
(2)乙同学认为可用CaCl2溶液鉴别Na2CO3和NaHCO3溶液.
甲、乙两同学的猜想是依据澄清石灰水、CaCl2溶液分别与Na2CO3溶液反应均有沉淀产生;又知道Ca(HCO3)2可溶于水,因此猜测澄清石灰水、CaCl2溶液分别与NaHCO3溶液混合不会产生沉淀,从而鉴别出两种溶液.
(3)丙同学认为固体Na2CO3、NaHCO3可用加热的方法鉴别.
[实验探究](1)甲同学在两支分别盛有少量Na2CO3、NaHCO3溶液的试管中,各加入澄清石灰水,观察到两支试管中的现象相同,均产生了白色沉淀,实验结果与猜想不一致,即不能用澄清石灰水鉴别Na2CO3和NaHCO3溶液.
(2)乙同学将CaCl2溶液加入到分别盛有少量Na2CO3、NaHCO3溶液的试管中,发现两支试管中也都产生了白色沉淀,实验结果出乎意料,但根据观察到的其他实验现象,他认为仍可用CaCl2溶液鉴别Na2CO3和NaHCO3溶液.
(3)丙同学分别取了一定量的Na2CO3、NaHCO3固体于大试管中加热(如图所示):
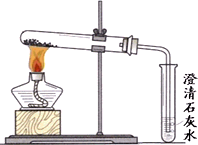
①加热Na2CO3时,开始即见小试管中有少量气泡产生,继续加热,气泡逐渐减少,未见澄清石灰水变浑浊,
②加热NaHCO3时,丙同学观察到实验现象与①不同,证实了自己的猜想是合理的.
[问题讨论](1)小组同学对上述实验展开了讨论,对甲同学的两个实验进行了比较,并从物质在溶液中解离出不同离子的微观角度分析了原因(如图1、图2).请写出Na2CO3与澄清石灰水发生反应的化学方程式________;写出NaHCO3与澄清石灰水混合时参与反应的离子:________.
(2)乙同学的两个实验中,大家对CaCl2与Na2CO3溶液的反应比较熟悉,而对CaCl2与NaHCO3溶液混合产生的现象难以理解,同学们又进一步查阅了资料,了解到CaCl2与NaHCO3溶液可发生如下反应:CaCl2+2NaHCO3=CaCO3↓+2NaCl+CO2↑+H2O,因而同学们知道了乙同学是通过观察到________现象来鉴别Na2CO3和NaHCO3溶液的.
至于CaCl2与NaHCO3溶液为什么能发生上述反应,老师指出其反应原理较复杂,有待于今后学习中进一步探究.
(3)丙同学在加热Na2CO3固体时,开始产生少量气泡的原因是________;根据你分析:Na2CO3受热________分解(填“易”或“不易”).在加热NaHCO3固体时,丙同学观察到的实验现象是________(任写一种).
[拓展应用](1)固体Na2CO3中混有少量NaHCO3,可通过________方法除去.
(2)把105 g氯化钙溶液与100 g 5.3%的碳酸钠溶液混合,恰好完全反应,则反应所得溶液中溶质的质量分数是多少?(写出完整的解题过程).
某学习小组的同学在学习了Na2CO3、NaHCO3的性质后,了解到它们都能与盐酸反应产生CO2气体,那么如何鉴别Na2CO3和NaHCO3呢?带着这样的疑问,他们进行了下列探究:
【查阅资料】(1)Ca(HCO3)2可溶于水;
(2)NaHCO3固体受热分解生成碳酸钠、二氧化碳和水。
【猜想】(1)甲同学认为可用澄清石灰水鉴别Na2CO3和NaHCO3溶液。
(2)乙同学认为可用CaCl2溶液鉴别Na2CO3和NaHCO3溶液。
甲、乙两同学的猜想是依据澄清石灰水、CaCl2溶液分别与Na2CO3溶液反应均有沉淀产生;又知道Ca(HCO3)2可溶于水,因此猜测澄清石灰水、CaCl2溶液分别与NaHCO3溶液混合不会产生沉淀,从而鉴别出两种溶液。
(3)丙同学认为固体Na2CO3、NaHCO3可用加热的方法鉴别。
【实验探究】(1)甲同学在两支分别盛有少量Na2CO3、NaHCO3溶液的试管中,各加入澄清石灰水,观察到两支试管中的现象相同,均产生了白色沉淀,实验结果与猜想不一致,即不能用澄清石灰水鉴别Na2CO3和NaHCO3溶液。
(2)乙同学将CaCl2溶液加入到分别盛有少量Na2CO3、NaHCO3溶液的试管中,发现两支试管中也都产生了白色沉淀,实验结果出乎意料,但根据观察到的其他实验现象,他认为仍可用CaCl2溶液鉴别Na2CO3和NaHCO3溶液。
(3)丙同学分别取了一定量的Na2CO3、NaHCO3固体于大试管中加热(如图1):
①加热Na2CO3时,开始即见小试管中有少量气泡产生,继续加热,气泡逐渐减少,未见澄清石灰水变浑浊,
②加热NaHCO3时,丙同学观察到实验现象与①不同,证实了自己的猜想是合理的。
【问题讨论】(1)小组同学对上述实验展开了讨论,对甲同学的两个实验进行了比较,并从物质在溶液中解离出不同离子的微观角度分析了原因(如图2、图3)。请写出Na2CO3与澄清石灰水发生反应的化学方程式 ;写出NaHCO3与澄清石灰水混合时参与反应的离子: 。
(2)乙同学的两个实验中,大家对CaCl2与Na2CO3溶液的反应比较熟悉,该反应的化学方程式为 ;而对CaCl2与NaHCO3溶液混合产生的现象难以理解,同学们又进一步查阅了资料,了解到CaCl2与NaHCO3溶液可发生如下反应:
CaCl2+2NaHCO3=CaCO3↓+2NaCl+CO2↑+H2O,因而同学们知道了乙同学是通过观察到
现象来鉴别Na2CO3和NaHCO3溶液的。
至于CaCl2与NaHCO3溶液为什么能发生上述反应,老师指出其反应原理较复杂,有待于今后学习中进一步探究。
(3)丙同学在加热Na2CO3固体时,开始产生少量气泡的原因是 ;根据你分析:Na2CO3受热 分解(填“易”或“不易”)。在加热NaHCO3固体时,丙同学观察到的实验现象是
(任写一种)。
【拓展应用】(1)固体Na2CO3中混有少量NaHCO3,可通过 方法除去。
(2)要除去Na2CO3溶液中混有的少量NaHCO3,可加入适量的 溶液。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com