
题目列表(包括答案和解析)
A.![]() B.
B.![]() g
g
C.![]() g D.
g D.![]() g
g
已知t℃下Na2SO3的溶解度是S g。一定质量的Na2SO3溶液加入ag Na2SO3,在t℃恰好饱和。若以Na2SO3·7H2O代替Na2SO3,也使原溶液在t℃恰好饱和,需加入Na2SO3·7H2O(摩尔质量为252g·mol-1)的质量是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
A. | B. | C. | D. |
(14分)近几年来,我国中东部地区陷入严重的雾霾天气,面对全球近期的气候异常,环境问题再次成为焦点。非金属氧化物的合理控制和治理是优化我们生存环境的有效途径之一。请运用化学反应原理知识,回答下列问题:
Ⅰ、目前,消除氮氧化物污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-57kJ?mol-1
②4CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ?mol-1
③H2O(g)=H2O(l) △H=-44.0kJ?mol-1
写出CH4(g)与NO2(g)反应生成N2(g),CO2(g)和H2O(l)的热化学方程式________________。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+ 2NO(g) N2(g)+CO2(g)某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度(mol/L) 时间(min) | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
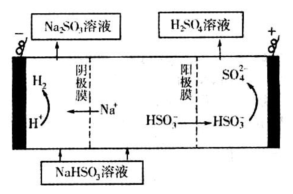
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
 N2(g)+CO2(g)某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:| 浓度(mol/L) 时间(min) | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com