
题目列表(包括答案和解析)
实验室里需要纯净的氯化钠溶液,但现有的氯化钠晶体中混有少量硫酸钠和碳酸氢铵,设计一组实验去杂质。试简单回答下列问题。
(1)除去碳酸氢铵,用加热方法好,还是加入强碱微热的方法好?
答:______________,原因是____________________,判断碳酸氢铵已完全除去的方法是__________________________。
(2)加热的固体残渣溶于水后,应该用氯化钡溶液还是硝酸钡溶液除去SO42-?
答:_____________,原因是______________,判断SO42-已完全除去的方法是_________。
实验室里需要纯净的氯化钠溶液,但现有的氯化钠晶体中混有少量硫酸钠和碳酸氢铵,设计一组实验去杂质。试简单回答下列问题。
(1)除去碳酸氢铵,用加热方法好,还是加入强碱微热的方法好?
答:______________,原因是____________________,判断碳酸氢铵已完全除去的方法是__________________________。
(2)加热的固体残渣溶于水后,应该用氯化钡溶液还是硝酸钡溶液除去SO42-?
答:_____________,原因是______________,判断SO42-已完全除去的方法是_________。
| (1-84a) |
| 18a |
| (1-84a) |
| 18a |
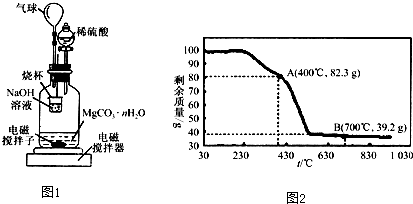
要设计一套实验室利用液体和液体加热反应制备气体的装置,现设计了五步操作,正确的程序是( )
①将蒸馏烧瓶固定在铁架台上 ②将酒精灯放在铁架台上,根据酒精灯确定铁圈高度,固定铁圈,放好石棉网
③用漏斗向蒸馏烧瓶中加入一种液体反应物,再向分液漏斗中加入另一种液体反应物,并将导气管放入气体收集器中
④检查装置的气密性(利用对固定装置微热的方法检查气密性) ⑤在蒸馏烧瓶上装好分液漏斗,连接好导气管
A.②①⑤④③ B.④①②⑤③
C.①②⑤④③ D.①⑤④②③
(18分)晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如 下:
下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制SiHCl3:Si+3HCl SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅。
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为: 。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):

①装置B中的试剂是 ,装置C中的烧瓶需要加热,其目的是: 。
②反应一段时间后,装置D中观察到的现象是 ,装置D不能采用普通玻璃管的原因是 ,装置D中发生反应的化学方程式为 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com