(2011?绵阳模拟)某化学兴趣小组为探究
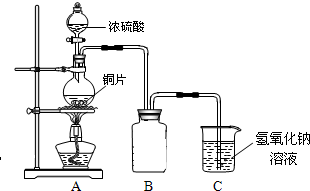
铜跟浓硫酸的反应情况,用如图所示装置先进行了有关实验:
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整.
(2)实验中他们取6.4g铜片和12ml 18mol?L
-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①请写铜跟浓硫酸反应的化学方程式:
Cu+2H
2SO
4(浓)CuSO
4+2H
2O+SO
2↑
Cu+2H
2SO
4(浓)CuSO
4+2H
2O+SO
2↑
.
②为什么有一定量的余酸但未能使用铜片完全溶解,你认为原因是:
随反应进行,硫酸浓度变稀,Cu不与稀H2SO4反应
随反应进行,硫酸浓度变稀,Cu不与稀H2SO4反应
.
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是
AD
AD
(填写字母编号).
A、铁粉 B、BaCl
2溶液 C、银粉 D、Na
2CO
3溶液
(3)为定量测定余酸的物质的量浓度,甲、乙两同学进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO
2的量,再计算余酸的物质的量浓度.他认为测定SO
2的量的方法有多种,请问下列实验方案中不可行的是
ABC
ABC
(填写字母编号).
A、将装置产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
B、将装置A产生的气体缓缓通入足量的硫酸酸化的KMnO
4溶液,再加入足量BaCl
2溶液,过滤、洗涤、干燥、称量沉淀
C、用排水法测定装置A产生气体的体积(已折算成标准状况)
D、用排饱和NaHSO
3溶液的方法测出装置A产生气体的体积(已折算成标准状况)
②乙同学设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL于锥形瓶中,用标准氢氧化钠溶液进行滴淀(已知:Cu(OH)
2开始沉淀的pH约为5),能否通过测出消耗NaOH溶液的体积来求余酸的物质的量的浓度
否
否
(填“能”或“否”),其理由是
含Cu2+的溶液显蓝色,干扰终点判断
含Cu2+的溶液显蓝色,干扰终点判断
.

 (2011?绵阳模拟)某化学兴趣小组为探究
(2011?绵阳模拟)某化学兴趣小组为探究
 某化学兴趣小组为探究
某化学兴趣小组为探究