
题目列表(包括答案和解析)
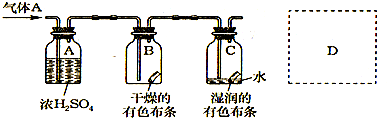

 甲同学设计如图所示装置研究氯气能否与水发生反应.气体a的主要成分是含有少量空气和水蒸气的氯气.
甲同学设计如图所示装置研究氯气能否与水发生反应.气体a的主要成分是含有少量空气和水蒸气的氯气.(10分)某学生应用下图所示的装置来研究物质的性质,其中气体X的主要成分是氯气,杂质是空气和水蒸气。
回答下列问题:
(1)该项研究(实验)的主要目的是 。
(2)浓H2SO4的作用是 ,
与研究目的直接相关的实验现象是______________________________________。
(3)该实验装置设计上存在的缺陷为 _________________ ,
请在上图的D处画出能克服该缺陷的装置。
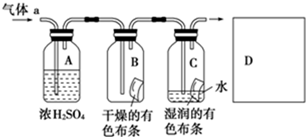
某生应用下图所示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气。
回答下列问题:
(1)该项研究(实验)的目的是_________________________________________。
(2)浓H2SO4的作用是_______________________________________________。
与研究目的直接相关的实验现象是_____________________________________________。
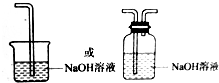
(3)从物质的性质方面看,这套设计还存在隐患,事故表现是____________________。
请在图中的虚线框内以图的形式表明克服事故隐患的措施。
(10分)某学生应用下图所示的装置来研究物质的性质,其中气体X的主要成分是氯气,杂质是空气和水蒸气。
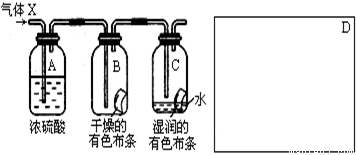
回答下列问题:
(1)该项研究(实验)的主要目的是 。
(2)浓H2SO4的作用是 ,
与研究目的直接相关的实验现象是______________________________________。
(3)该实验装置设计上存在的缺陷为 _________________ ,
请在上图的D处画出能克服该缺陷的装置。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com