
题目列表(包括答案和解析)
| A、用玻璃棒蘸取废水样品,沾在用蒸馏水润湿的pH试纸上测定其pH | B、将无色酚酞试液滴入废水样品中以验证其酸性 | C、该工业废水中c(H+)>c(OH-) | D、测得废水样品的pH=4,说明该废水样品中c(H+)=4.0 mol?L-1 |
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体. |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀. |
| 实验步骤 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) | ▲ | ▲ | ▲ | C | D | ▲ |
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 15 | 200 | m1 |
| 2 | 50.0 | 2.0 | 薄片 | 25 | 100 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m3 |
| 4 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m4 |
| 5 | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
| 6 | 50.0 | 4.0 | 粉末 | 25 | t2 | m5 |
| 7 | 50.0 | 6.0 | 粉末 | 25 | t3 | 14.9 |
| 8 | 50.0 | 8.0 | 粉末 | 25 | t4 | 19.3 |
| 9 | 50.0 | 10.0 | 粉末 | 25 | t5 | m6 |
| 10 | 50.0 | 12.0 | 粉末 | 25 | t6 | 19.3 |
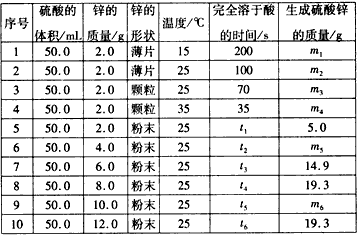
(12分)控制变量法是化学实验的一种常用方法,下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据(计算结果精确到小数点后一位):
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/ ℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 15 | 200 | m1 |
2 | 50.0 | 2.0 | 薄片 | 25 | 100 | m2 |
3 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m3 |
4 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m4 |
5 | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
6 | 50.0 | 4.0 | 粉末 | 25 | t2 | m5 |
7 | 50.0 | 6.0 | 粉末 | 25 | t3 | 14.9 |
8 | 50.0 | 8.0 | 粉末 | 25 | t4 | 19.3 |
9 | 50.0 | 10.0 | 粉末 | 25 | t5 | m6 |
10 | 50.0 | 12.0 | 粉末 | 25 | t6 | 19.3 |
分析以下数据,回答下列问题:
(1)实验1和实验2表明,______________对反应速率有影响,对同一规律进行研究的实验还有一组是______________________(填实验序号)。
(2)下列说法正确的是_______
A.t1<70 B. m1<m2 C. m6=19.3 D. t1>t4
(3)本实验还可以研究___________________________对化学反应速率的影响。
(4)硫酸的物质的量浓度是______mol/L, 实验6生成的硫酸锌的质量m5=________g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com