
题目列表(包括答案和解析)
Ⅰ.利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理.用乙烯作为还原剂将氮的氧化物还原为N2是燃煤烟气的一种脱硝(除NOx)技术.其脱硝机理如图甲,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图乙所示.
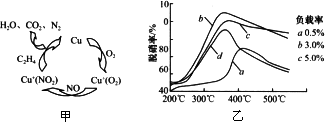
①写出该脱硝过程中乙烯和NO2反应的化学方程式________.
②为达到最佳脱硝效果,应采取的条件________.
Ⅱ.有学者设想以下图所示装置用电化学原理将燃煤烟气中的CO2、SO2转化为重要化工原料.
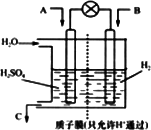
若A为SO2,B为O2,C为H2SO4.科研人员希望每分钟从C处获得50 mL 10 mol/L H2SO4,则A处通人烟气(SO2的体积分数为1%)的速率为________L/min(标准状况).
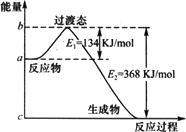
Ⅲ.(1)下图是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________,ΔH的变化是________(填“增大”、“减小”、“不变”).
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1,
CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1,
②CH3OH(g)+![]() O2(g)
O2(g)![]() CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
则甲醇蒸气完全燃烧生成液态水的热化学方程式为________.
写出甲醇燃料电池在酸性条件下的负极电极反应式________.
| 1 | 2 |
合理利用资源,降低碳的排放,实施低碳经济是今后经济生活主流方向。
⑴下列措施不利于有效减少二氧化碳排放的是 。
A.植树造林,保护森林,保护植被
B.加大对煤和石油的开采,并鼓励使用石油液化气
C.推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高
D.倡导出行时多步行和骑自行车,建设现代物流信息系统,减少运输工具空驶率
⑵科学家致力于二氧化碳的“组合转化”技术研究,如将CO2和H2以1∶4比例混合通入反应器,适当条件下反应可获得一种能源。完成以下化学方程式:CO2+4H2 +2H2O。
+2H2O。
⑶CO2合成生产燃料甲醇(CH3OH)是碳减排的新方向。进行如下实验:某温度下在1 L的密闭容器中,充2 mol CO2和6 mol H2,发生:CO2(g)+3H2(g ) CH3OH(g)+H2O(g)能判断该反应已达化学反应限度标志的是 (填字母)。
CH3OH(g)+H2O(g)能判断该反应已达化学反应限度标志的是 (填字母)。
A.CO2百分含量保持不变
B.容器中H2浓度与CO2浓度之比为3:1
C.容器中混合气体的质量保持不变
D.CO2生成速率与CH3OH生成速率相等
现测得CO2和CH3OH(g)的浓度随时间变化如左下图所示。从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)。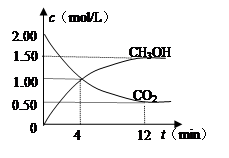
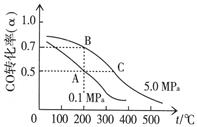
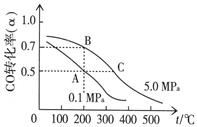
⑷CO在催化作用下也能生成甲醇:CO(g)+2H2(g)  CH3OH(g);已知密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率(α)与温度、压强的关系如右上图所示。
CH3OH(g);已知密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率(α)与温度、压强的关系如右上图所示。
①若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
②若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为VAL,则A、B两点时容器中,n(A)总︰n(B)总= 。
⑸以KOH为电解质的甲醇燃料电池总反应为:2CH3OH+3O2+4KOH= 2K2CO3+6H2O,通入甲醇的电极为燃料电池的负极,正极发生的电极反应式为 。
 +2H2O。
+2H2O。 CH3OH(g)+H2O(g)能判断该反应已达化学反应限度标志的是 (填字母)。
CH3OH(g)+H2O(g)能判断该反应已达化学反应限度标志的是 (填字母)。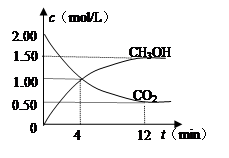
 CH3OH(g);已知密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率(α)与温度、压强的关系如右上图所示。
CH3OH(g);已知密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率(α)与温度、压强的关系如右上图所示。近20年来,对于氢能源的研究获得了迅速发展,像电一样,氢是一种需要依靠其他能源如石油、煤、太阳能等的能量来制取的所谓的“二级能源”,而存在于自然界的可以提供现成形式能量的能源称为一级能源,如煤、石油、太阳能和原子能等。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是_______________。
A.电解水B.锌和稀硫酸反应
C.光解海水D.以石油、天然气为原料
(2)氢气燃烧时耗氧量小,发热量大。已知碳和氢气燃烧的热化学方程式为:
C(s)+O2(g)====CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+1/2O2(g)====H2O(l) ΔH=-285.8 kJ·mol-1
试通过计算说明等质量的氢气和碳燃烧时产生热量的比是_______________。
(3)氢能源有可能实现能源的贮存,也可能实现经济、高效的输送。研究表明过渡金属的氢化物(又称间充氢化物)中,氢原子填充在金属的晶格间隙之间时,其组成不固定,通常是非化学计量的,如LaH2.76、TiH1.73、Ce H2.69。已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为10.64 g·cm-3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式_________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com