
题目列表(包括答案和解析)
由周期表中前20号元素组成的单质X2、Y和化合物Z的有关信息如下表,X2、Y 和Z之间的转化关系如右图(其他无关物质已略去)。请回答下列问题:
| 元素X | 易形成-1价18电子的单核离子 |
| 元素Y | 第3周期第ⅥA族 |
| 化合物Z | 所含阳离子有3个电子层 |
| 常温下0.1 mol·L-1的水溶液pH=13 |
(1)用化学方程式表示X2在工业生产上的一种用途 。
(2) 比较元素X与Y的氢化物稳定性: 比 稳定(填氢化物化学式)。
(3)将0.24 mol Y氧化物YO2和 0.11 mol氧气放入容积为1 L的密闭容器中,一定条件下反应达到平衡,得到0.12 mol YO3气体,同时放出热量11.8kJ。
①该反应平衡常数= 。
②该反应的热化学方程式为 。
(4) C能与稀硫酸反应生成能使品红溶液褪色的气体,D中所含阴、阳离子的电子层排布相同。
①写出Y与Z反应的离子方程式
②将20 mL 0.5 mol·L-1 C溶液逐滴加入到V mL 0.2 mol·L-1 KMnO4溶液(硫酸酸化)中,溶液恰好褪色(此时Mn元素恰好变为Mn2+)。计算V= 。
(5)用石墨作电极,在隔膜电解槽中电解A的溶液,可制得Z的水溶液,请写出甲烷燃料电池(Z的水溶液为电解质溶液)负极的电极反应式

A、B、C、X、Y、Z元素的原子序数依次增大,根据信息完成问题:
|
元素A |
各能级上的电子数相等 |
|
元素C |
某种核素原子的质量数为18,中子数为10 |
|
元素X |
单质是良好的半导体材料 |
|
元素Y |
其单质为淡黄色晶体,常用来处理打碎的水银温度计 |
|
元素Z |
3d能级上有4个未成对电子 |
(1)Z元素在周期表中的位置 ,其电子排布式 。
(2)AO2的熔点远低于XO2熔点的主要原因是 。
(3)X的氧化物和NaOH溶液反应的化学方程式 。
(4)B、C气态基态原子的第一电离能的大小关系为 。
(5)请用离子方程式表达Na2Y溶液呈碱性的原因 。
(6)已知CH3COOH(aq)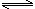 H+(aq)+CH3COO—(aq)
△H=+akJ/mol
H+(aq)+CH3COO—(aq)
△H=+akJ/mol
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) △H=—bkJ/mol
则中和热的△H= kJ/mol
A、B、C、X、Y、Z元素的原子序数依次增大,根据信息完成问题:
| 元素A | 各能级上的电子数相等 |
| 元素C | 某种核素原子的质量数为18,中子数为10 |
| 元素X | 单质是良好的半导体材料 |
| 元素Y | 其单质为淡黄色晶体,常用来处理打碎的水银温度计 |
| 元素Z | 3d能级上有4个未成对电子 |
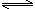 H+(aq)+CH3COO—(aq) △H=+akJ/mol
H+(aq)+CH3COO—(aq) △H=+akJ/mol| 元素A | 各能级上的电子数相等 |
| 元素C | 某种核素原子的质量数为18,中子数为10 |
| 元素X | 单质是良好的半导体材料 |
| 元素Y | 其单质为淡黄色晶体,常用来处理打碎的水银温度计 |
| 元素Z | 3d能级上有4个未成对电子 |
 H+(aq)+CH3COO—(aq) △H=+akJ/mol
H+(aq)+CH3COO—(aq) △H=+akJ/mol一定温度下, 在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g) aZ(g)+W(g) ΔH=-Q kJ·mol-1(Q>0,a是正整数)。当反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;平衡后混合气体的平均相对分子质量与温度的关系如图所示,下列说法不正确的是( )
aZ(g)+W(g) ΔH=-Q kJ·mol-1(Q>0,a是正整数)。当反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;平衡后混合气体的平均相对分子质量与温度的关系如图所示,下列说法不正确的是( )
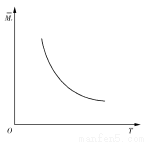
A.温度升高,平衡常数K减小
B.化学计量数a为1
C.维持温度不变,若起始时向容器中加入a mol Z、1 mol W反应达到平衡后放出的热量为Q2 kJ,则Q1+Q2=Q且Q>Q1>Q2
D.X的转化率α=Q1/Q
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com