
题目列表(包括答案和解析)
【南海中学2008届高三化学第一次月考】将下列物质分别加到溴水中,振荡后,因发生化学变化而使溴水褪色的是:①硫化钠②氢氧化钠③乙酸④镁粉⑤裂化汽油⑥甲苯
A.①②③⑤ B. ②④⑤⑥
C. ①②④⑤ D. ②③④⑤
|
江苏省淮安中学2007届高三化学第二次月考试卷下列有关说法正确的是 | |
| [ ] | |
A. |
物质熔沸点的高低顺序是:氧化镁>氯化钠>冰>氖气 |
B. |
微粒半径由大到小顺序是:O2->N3->Li+ |
C. |
溶液中结合H+能力由强到弱的顺序是:SO42->H2PO4->CH3COO->HCO3- |
D. |
CO2、HClO、CF4、PCl3四物质分子中的所有原子都满足最外层为8电子的稳定结构 |
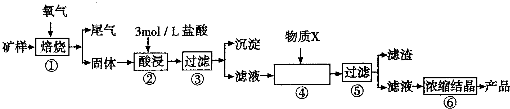
| 金属离子 | 开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| ||
| ||

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com