
题目列表(包括答案和解析)
(1)德国ICI公司用微生物合成技术制得新型聚酯塑料,聚-3-羟基丁酸(P-3-HB),成为一种新的生物降解性热塑性材料,用于农、渔、医用缝合线及骨折固定剂。请写出P-3-HB的结构简式_______________________。
(2)1996年美国罗姆斯公司研究的对环境安全的船舶防垢剂——“海洋9号”,获得美国“总统绿色化学挑战奖”。其结构简式为:
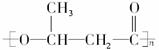
请填写下列空白:
①“海洋9号”的分子式为:_________________。
②该物质能否发生加成反应___________________(填“能”或“不能”)。若能,1 mol该物质最多可与_________________mol H2加成。
③结构中的两个氯原子能否发生取代反应_________________ (填“能”或“不能”),如能,请举例,用化学方程式表示___________________________________________________。
⑴开始时反应速率的大小 ;
⑵三支试管中参加反应的锌的质量 ;
⑶反应终了所需时间 ,因为 。
称取三份锌粉,分盛在三支试管里,按下列要求另加物质后,塞上导管塞子,定时间测定生成氢气的体积。试管甲加入p=3的盐酸10 mL,乙加入pH=3的醋酸10 mL,丙加入pH=3的醋酸和少量胆矾粉末。若反应结束生成氢气一样多,且没有剩余的锌,请用>、=、<回答:
⑴开始时反应速率的大小 ;
⑵三支试管中参加反应的锌的质量 ;
⑶反应终了所需时间 ,因为 。
 研究金属的冶炼对人类有重要意义.
研究金属的冶炼对人类有重要意义.(1)已知:P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ/mol
P(红磷,s)+5/4O2(g)=1/4 P4O10(s) ΔH=-738.5kJ/mol
则白磷转化为红磷的热化学方程式为 ;由此说明红磷的稳定性比白磷 。
(2)明矾[KAl(SO4)2·12H2O]水溶液呈 (填“酸”、“碱”或“中”)性;明矾还能净水,用离子方程式解释其原因为 。
(3)电解池的能量转化形式为 ,原电池反应 (填“一定”或“不一定”)自发。
(4)pH=3的盐酸和pH=3的醋酸溶液各稀释至其体积的100倍,稀释后盐酸的pH (填“大于”、“小于”或“等于”)醋酸的pH;常温时pH=x的盐酸和pH=y的NaOH溶液以1︰10的体积比混合,反应后溶液恰好呈中性,则x、y满足的关系是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com