
题目列表(包括答案和解析)
(14分)广东省海水资源丰富,海水中主要含![]()
![]() 等离子。合理利用海水资源和保护环境是我省可持续发展的重要保证。
等离子。合理利用海水资源和保护环境是我省可持续发展的重要保证。
I:火力发电是广东的重要能源,但是烧煤排放的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示:
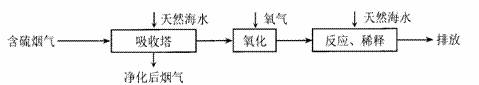
(l)天然海水的pH≈8,呈弱碱性。用离子方程式解释原因_(任写一个)。
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其原理化学反应方程式是 ;氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是
II:重金属离子对河流海洋造成严重污染。某化工厂废水(pH=2.0,d≈1 g?mL-1)中
含有Ag+, Pb 2+等重金属离子,其浓度各约为O.Olmol?L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:

(3)你认为往废水中投入_(填字母序号),沉淀效果最好。
A. NaOH B.Na2S C.KI D. Ca(OH)2
(4)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=_。
(5)如果用食盐处理其只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%,若环境要求排放标准为c (Ag+)低于1.0X10一5mol ?L-1,问该工厂处理后的废水中Ag+.是否符合排放标准?要求写出计算过程。已知Ksp (AgCl) =1.8X10-10 mol2?L-1
(16分)广东省有着丰富的海洋资源。海水提取食盐和Br2以后的盐卤可以用来制备纯净的MgCl2或MgO。盐卤中含有Mg2+、Cl-,还含有少量Na+、Fe2+、Fe3+、SO42- 等。制备流程如下图
(1)滤液Ⅱ中所含主要的杂质离子是 (写离子符号)。
(2) 加入NaClO的作用是 。
(3)温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如图所示。
请回答下列问题:
①写出P(HCl)g = 0.25MPa,温度从300℃升高到550℃时反应的化学方程式 ;
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是
;若要得到无水MgCl2须采取的措施是 。
(16分)广东省有着丰富的海洋资源。海水提取食盐和Br2以后的盐卤可以用来制备纯净的MgCl2或MgO。盐卤中含有Mg2+、Cl-,还含有少量Na+、Fe2+、Fe3+、SO42-等。制备流程如下图
(1)滤液Ⅱ中所含主要的杂质离子是 (写离子符号)。
(2) 加入NaClO的作用是 。
(3)温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如图所示。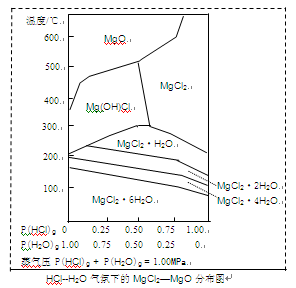
请回答下列问题:
①写出P(HCl)g = 0.25MPa,温度从300℃升高到550℃时反应的化学方程式 ;
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是
;若要得到无水MgCl2须采取的措施是 。
(16分)广东省有着丰富的海洋资源。海水提取食盐和Br2以后的盐卤可以用来制备纯净的MgCl2或MgO。盐卤中含有Mg2+、Cl-,还含有少量Na+、Fe2+、Fe3+、SO42- 等。制备流程如下图
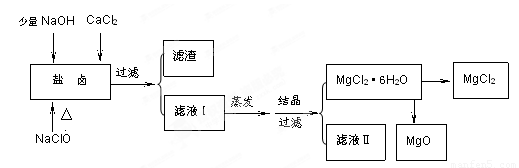
(1)滤液Ⅱ中所含主要的杂质离子是 (写离子符号)。
(2) 加入NaClO的作用是 。
(3)温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如图所示。
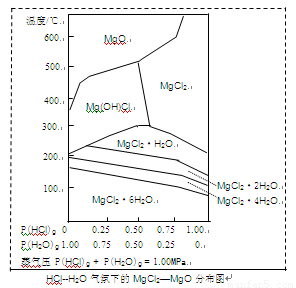
请回答下列问题:
①写出P(HCl)g = 0.25MPa,温度从300℃升高到550℃时反应的化学方程式 ;
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是
;若要得到无水MgCl2须采取的措施是 。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com