
题目列表(包括答案和解析)
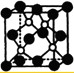 已知A、B、C、D四种短周期元素在周期表中的相对位置如表,其中D的原子序数是A的原子序数的3倍.A与D组成的物质是一种超硬耐磨涂层材料,图为其晶体结构中最小的重复结构单元,其中的每个原子最外层均满足8电子稳定结构.下列有关说法正确的是( )
已知A、B、C、D四种短周期元素在周期表中的相对位置如表,其中D的原子序数是A的原子序数的3倍.A与D组成的物质是一种超硬耐磨涂层材料,图为其晶体结构中最小的重复结构单元,其中的每个原子最外层均满足8电子稳定结构.下列有关说法正确的是( ) 
| 元素 | 相关结构和性质 |
| A | 其单质的一种晶体不是金属晶体,但是电的良导体,且难熔、质软并有润滑性,可用作原子核反应堆的慢化剂、火箭发动机喷灌和电极材料等. |
| B | 其单质既能与强酸溶液反应,又能与强碱溶液反应,其简单离子在第三周期单核离子中半径最小. |
| C | 是蛋白质的组成元素之一,原子核外有三种不同能量的电子,且未成对电子数最多. |
| D | 原子核外最外层电子排布式为nsnnp2n+1 |
| ||
| ||
| I1 | I2 | I3 | I4 | |
| C | 738 | 1451 | 7733 | 10540 |
| D | 577 | 1817 | 2745 | 11578 |
| 单键 | 双键 | 叁键 | ||
| AB | 键能(kJ?mol-1) | 357.7 | 798.9 | 1071.9 |
| 甲 | 键能(kJ?mol-1) | 154.8 | 418.4 | 941.7 |
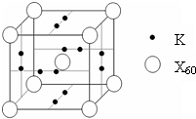 (4)E能与AB形成配合物,其中E提供
(4)E能与AB形成配合物,其中E提供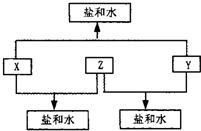 (2010?潍坊一模)已知:A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,试推断回答下列问题.
(2010?潍坊一模)已知:A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,试推断回答下列问题.
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com