
题目列表(包括答案和解析)
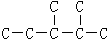 ,此烷烃的一溴代物有
,此烷烃的一溴代物有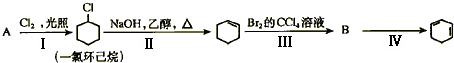
| |||||||||||||||
| |||||||||||||||
(14分)Ⅰ.化学是一门以实验为基础的学科,下列实验操作描述中正确的是_ _
① 为使稀硫酸和锌制取氢气的速率加快,可向稀硫酸中加入用铜丝网包裹的锌粒
② 用托盘天平称取10. 4 g食盐时,将食盐放在右盘中的纸片上称量
③ 配制一定物质的量浓度的溶液时,容量瓶洗涤后未进行干燥
④ 以酚酞作指示剂,用标准浓度的盐酸滴定NaOH溶液,待溶液变成浅红色时即停止滴定
⑤ 测定溶液的pH时,用洁净、干燥的玻璃棒蘸取待测溶液,点在试纸中部,待变色后与标准比色卡对照读数
Ⅱ.201 1年3月12日,日本因大地震导致福岛核泄漏,主要泄漏物为碘131和绝137。在
被辐射地区,每天服用一片碘片可以起到一定的预防作用。我国部分地区出现抢购加碘食盐现象。为此卫生部有关专家指出多吃碘盐起不到预防放射性碘辐射的作用,且我国碘盐丰富,不必抢购。碘片和碘盐相关信息:
碘片:主要成分是碘化钾,每片含100毫克的碘,防核辐射每天服一片。
碘盐:加碘食盐,主要成分是氯化钠、碘酸钾,每公斤食用盐中碘含量为20—30毫克。
KIO3可用电解法制得:以石墨为阳极,不锈钢为阴极,在一定温度和电流下电解KI溶
液,总反应方程式为:KI+3H2O====KIO3 +3H2↑。
Na2S2O3可与I2反应:I2+2S2O32-(无色)→2I—+ S4O62-(无色)。回答下列问题:
(1)碘化钾、碘酸钾中的碘是碘127,则碘127和碘131的原子结构中不相同的是 ;以每公斤食用盐中碘含量为20毫克计,人每天吃____公斤盐才相当于服用一片碘片。说明靠吃碘盐来预防放射性碘 (填“有”、“无”)作用。
(2)电解法制KIO3中,阳极的电极反应式为_ ___;阴极附近pH值 (填“增大”、“减小”、“不变”)。
(3)为防止不法商贩乘机销售假冒加碘食盐,有关部门加强了检测。下面是对某超市出售的加碘精制盐的检测过程:
①取该食盐样品100.0 g加入适量的蒸馏水,振荡使固体完全溶解,然后加入用盐酸酸化的
淀粉- KI溶液,结果溶液呈蓝色,有关反应的离子方程式为 ;
②用0.010mol·L—1的Na2S2O3溶液滴定,当用去Na2S2O3溶液12.00mL时蓝色刚好褪去,
该加碘食盐中KIO3的含量为 mg/kg。由此可判定该食盐为 (填“合格”或“不合格”)产品。
(14分)Ⅰ.化学是一门以实验为基础的学科,下列实验操作描述中正确的是_ _
①为使稀硫酸和锌制取氢气的速率加快,可向稀硫酸中加入用铜丝网包裹的锌粒
②用托盘天平称取10.4 g食盐时,将食盐放在右盘中的纸片上称量
③配制一定物质的量浓度的溶液时,容量瓶洗涤后未进行干燥
④以酚酞作指示剂,用标准浓度的盐酸滴定NaOH溶液,待溶液变成浅红色时即停止滴定
⑤测定溶液的pH时,用洁净、干燥的玻璃棒蘸取待测溶液,点在试纸中部,待变色后与标准比色卡对照读数
Ⅱ.201 1年3月12日,日本因大地震导致福岛核泄漏,主要泄漏物为碘131和绝137。在
被辐射地区,每天服用一片碘片可以起到一定的预防作用。我国部分地区出现抢购加碘食盐现象。为此卫生部有关专家指出多吃碘盐起不到预防放射性碘辐射的作用,且我国碘盐丰富,不必抢购。碘片和碘盐相关信息:
碘片:主要成分是碘化钾,每片含100毫克的碘,防核辐射每天服一片。
碘盐:加碘食盐,主要成分是氯化钠、碘酸钾,每公斤食用盐中碘含量为20—30毫克。
KIO3可用电解法制得:以石墨为阳极,不锈钢为阴极,在一定温度和电流下电解KI溶
液,总反应方程式为:KI+3H2O====KIO3 +3H2↑。
Na2S2O3可与I2反应:I2+2S2O32-(无色)→2I—+ S4O62-(无色)。回答下列问题:
(1)碘化钾、碘酸钾中的碘是碘127,则碘127和碘131的原子结构中不相同的是 ;以每公斤食用盐中碘含量为20毫克计,人每天吃____公斤盐才相当于服用一片碘片。说明靠吃碘盐来预防放射性碘 (填“有”、“无”)作用。
(2)电解法制KIO3中,阳极的电极反应式为_ ___;阴极附近pH值 (填“增大”、“减小”、“不变”)。
(3)为防止不法商贩乘机销售假冒加碘食盐,有关部门加强了检测。下面是对某超市出售的加碘精制盐的检测过程:
①取该食盐样品100.0 g加入适量的蒸馏水,振荡使固体完全溶解,然后加入用盐酸酸化的
淀粉- KI溶液,结果溶液呈蓝色,有关反应的离子方程式为 ;
②用0.010mol·L—1的Na2S2O3溶液滴定,当用去Na2S2O3溶液12.00mL时蓝色刚好褪去,
该加碘食盐中KIO3的含量为 mg/kg。由此可判定该食盐为 (填“合格”或“不合格”)产品。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com