
题目列表(包括答案和解析)
高温及一定催化剂作用下,某反应达平衡,平衡常数K= 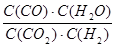 .恒容时,温度升高,H2浓度减小,下列说法正确的是( )
.恒容时,温度升高,H2浓度减小,下列说法正确的是( )
A.将容器体积变为原来2倍,CO的平衡浓度变为原来的2倍
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO2 +H2 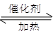 CO+H2O ; △H>O
CO+H2O ; △H>O
高温及一定催化剂作用下,某反应达平衡,平衡常数K= ![]() .恒容时,温度升高,H2浓度减小,下列说法正确的是( )
.恒容时,温度升高,H2浓度减小,下列说法正确的是( )
A.将容器体积变为原来2倍,CO的平衡浓度变为原来的2倍
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO2 +H2 ![]() CO+H2O ; △H>O
CO+H2O ; △H>O
高温及一定催化剂作用下,某反应达平衡,平衡常数K= .恒容时,温度升高,H2浓度减小,下列说法正确的是( )
A.将容器体积变为原来2倍,CO的平衡浓度变为原来的2倍
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO2 +H2 CO+H2O ; △H>O
高温及一定催化剂作用下,某反应达平衡,平衡常数K= 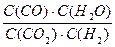 .恒容时,温度升高,H2浓度减小,下列说法正确的是( )
.恒容时,温度升高,H2浓度减小,下列说法正确的是( )
| A.将容器体积变为原来2倍,CO的平衡浓度变为原来的2倍 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
D.该反应化学方程式为CO2 +H2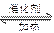 CO+H2O ;△H>O CO+H2O ;△H>O |
 运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义.
运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com