
题目列表(包括答案和解析)
(12分) 设反应①![]() 的平衡常数为
的平衡常数为![]() 。反应②
。反应②![]() 的平衡常数为
的平衡常数为![]() ,在不同温度下,
,在不同温度下,![]() 、
、![]() 的值如下:
的值如下:
| 温度 |
|
|
|
| 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(1)从上表可以推断:反应①是_______________ (填“吸”、“放”)热反应。
(2)现有反应③![]() 写出该反应的平衡常数K3的数学表达
写出该反应的平衡常数K3的数学表达
式:K![]() =____________。
=____________。
(3)根据反应①与②,可推导出K![]() 、K
、K![]() 与K
与K![]() 之间的关系式_______________。据
之间的关系式_______________。据
![]() 此关系式及上表数据,也能推断出反应③是“吸热”还是“放热”反应。问:要使反应
此关系式及上表数据,也能推断出反应③是“吸热”还是“放热”反应。问:要使反应
③在一定条件下建立的平衡向正反应方向移动,可采取的措施有___________________
(填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(4)图l、2表示该反应③在时刻t![]() 达到平衡、在时刻t
达到平衡、在时刻t![]() 分别因改变某个条件而发生变化的
分别因改变某个条件而发生变化的
情况:
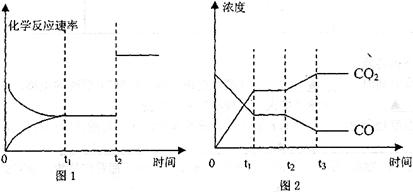
①图l中时刻t![]() 发生改变的条件是________________________________________
发生改变的条件是________________________________________
②图2中时刻t![]() 发生改变的条件是________________________________________
发生改变的条件是________________________________________
(10分)设反应①![]() 的平衡常数为K1,
的平衡常数为K1,
反应②![]() 的平衡常数为K2,
的平衡常数为K2,
测得在不同温度下,K1、K2的数值如下:

(l)若5000C时进行反应①,CO2起始浓度为2.00 mo I?L-1,则CO2转化率为_。
(2)9000C时进行反应③C02(g)+H2(g)![]() CO(g)+H20(g),其平衡常数K3数值为_。
CO(g)+H20(g),其平衡常数K3数值为_。
(3)反应②的焙变∆H____ 0(填“>”或“<”或“一”)
(4)700℃时反应②达到平衡,要使该平衡向右移动,当其他条件不变时,可采取的措施有______(填序号)。
A.缩小反应容器容积 B.加入更多的水蒸汽
C.升高温度到9000C D.使用合适的催化剂
(5)下列图像符合反应①的是_(填图像序一号)(图中v为速率,笋为混合气中CO的百分含量,T为温度)。

(12分)某反应的平衡常数表达式为,恒容时,温度升高.H2浓度减小。分析下列问题:
(1)该反应的化学方程式为:
(2)温度升高,该反应的K值______________(填“增大”“减小”或“不变”),化学平衡移动后达到新的平衡,CO2和CO体积比_______________(填“增大”“减小”或“不变”)。
(3)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生反应,CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min),850℃的化学平衡常数的值K=
(4)850℃时,在相同容器中发生反应CO2+H2 CO+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09 mol/L、 二氧化碳0.08 mol/L、氢气 0.08 mol/L,此时v(正) v(逆)(“大于”“小于”“等于”)
(12分)某反应的平衡常数表达式为 ,恒容时,温度升高.H2浓度减小。分析下列问题:
,恒容时,温度升高.H2浓度减小。分析下列问题:
(1)该反应的化学方程式为:
(2)温度升高,该反应的K值______________(填“增大”“减小”或“不变”),化学平衡移动后达到新的平衡,CO2和CO体积比_______________(填“增大”“减小”或“不变”)。
(3)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生反应,CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min),850℃的化学平衡常数的值K= 
(4)850℃时,在相同容器中发生反应CO2+ H2 CO+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09 mol/L、二氧化碳0.08 mol/L、氢气 0.08 mol/L,此时v(正) v(逆)(“大于”“ 小于”“等于”)
CO+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09 mol/L、二氧化碳0.08 mol/L、氢气 0.08 mol/L,此时v(正) v(逆)(“大于”“ 小于”“等于”)
(12分)某反应的平衡常数表达式为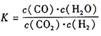 ,恒容时,温度升高.H2浓度减小。分析下列问题:
,恒容时,温度升高.H2浓度减小。分析下列问题:
(1)该反应的化学方程式为:
(2)温度升高,该反应的K值______________(填“增大”“减小”或“不变”),化学平衡移动后达到新的平衡,CO2和CO体积比_______________(填“增大”“减小”或“不变”)。
(3)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生反应,CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min),850℃的化学平衡常数的值K=
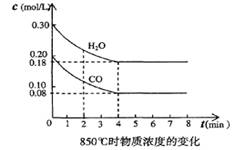
(4)850℃时,在相同容器中发生反应CO2+
H2  CO+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09 mol/L、 二氧化碳0.08 mol/L、氢气 0.08 mol/L,此时v(正) v(逆)(“大于”“
小于”“等于”)
CO+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09 mol/L、 二氧化碳0.08 mol/L、氢气 0.08 mol/L,此时v(正) v(逆)(“大于”“
小于”“等于”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com