
题目列表(包括答案和解析)
已知金属镁与氯化铁和氯化铜溶液反应有多种实验假设.甲、乙两位同学分别设计合理实验步骤探究该反应的历程.
提出猜想:
甲:推测镁与氯化铁、氯化铜水解产生的H+反应,拉动水解平衡生成H2.
乙:推测镁与氯化铁、氯化铜发生氧化还原反应.
结合对试剂的选择两位同学做了如下实验:
实验过程:
根据实验操作,实验现象,甲、乙再分别推测解释相应的结论.
(1)与甲同学的推测不尽符合的现象是________,________.
在实验①②的基础上甲进一步提出猜测:镁与H+反应拉动饱和氯化铁的水解平衡生成Fe(OH)3胶体,故未看到沉淀现象.
要验证甲的进一步猜想,还须补做的实验是________.
提出你的猜想________.
(2)乙:根据实验②可推测________.
(3)结合甲,乙两位同学的推测,你能否谈谈对上述实验事实的认识:
________.
(10分)已知金属镁与氯化铁和氯化铜溶液反应有多种实验假设。甲、乙两位同学分别设计合理实验步骤探究该反应的历程。
提出猜想:
甲:推测镁与氯化铁、氯化铜水解产生中的H+反应,拉动水解平衡生成生成H2。
乙:推测镁应与氯化铁、氯化铜发生氧化还原反应。
结合对试剂的选择两位同学做了如下实验:
实验过程
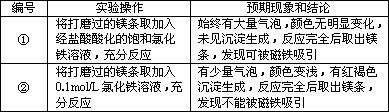
编号 | 实验操作 | 预期现象和结论 |
① | 将打磨过的镁条取加入经盐酸酸化的饱和氯化铁溶液,充分反应 | 始终有大量气泡,颜色无明显变化,未见沉淀生成反应完全后取出镁条发现可被磁铁吸引 |
② | 将打磨过的镁条取加入0.1mol/L氯化铁溶液,充分反应 | 有少量气泡,颜色变浅,有红褐色沉淀生成,反应完全后取出镁条发现不能被磁铁吸引 |
根据实验操作,实验现象,甲、乙分别推测解释相应的结论。
(1)写出生成Fe(OH)3胶体的离子方程式:
(2)与甲同学的推测不尽符合的现象是 ,
在实验①③的基础上甲进一步提出猜测:镁与H+反应拉动饱和氯化铁的水解平衡生成Fe(OH)3胶体,故未看到沉淀现象。
要验证甲的进一步猜想,还须补做的实验是
提出你的猜想
(3)乙:根据实验②可推测
(4)结合甲,乙两位同学的推测,你能否谈谈对上述实验事实的认识:
![]()
 某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究.
某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究.| 实验操作 | 实验现象 | |
| 方案一 | 取已除去表面氧化膜的镁条和铝条, 分别和0.1mol?L-1HCl溶液反应 |
均有气泡产生,镁条反应 比铝条反应更剧烈 |
| 方案二 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com