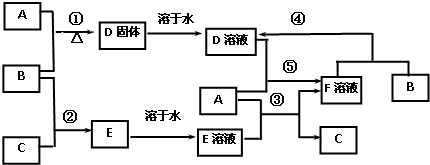
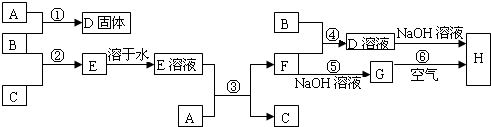
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下面框图进行反应,又知E溶液是实验室常用的酸,D溶液可与固体A反应生成F溶液.
请回答:
(1)A是
Fe
Fe
,F是
FeCl2
FeCl2
.
(2)反应⑥的化学方程式为:
4Fe(OH)2+O2+2H2O═4Fe(OH)3
4Fe(OH)2+O2+2H2O═4Fe(OH)3
,现象为
白色沉淀立即变灰绿色,最终变为红褐色
白色沉淀立即变灰绿色,最终变为红褐色
.
(3)反应③、④、⑤的离子方程式分别是:
Fe+2H+═Fe2++H2↑
Fe+2H+═Fe2++H2↑
、
2Fe2++Cl2═2Fe3++2Cl-
2Fe2++Cl2═2Fe3++2Cl-
、
Fe2++2OH-═Fe(OH)2↓
Fe2++2OH-═Fe(OH)2↓
.
(4)D的饱和溶液滴入沸腾的蒸馏水中,得到红褐色液体属于分散系中的
胶体
胶体
.