
题目列表(包括答案和解析)
 A、B、C和D均为短周期元素组成的非金属单质.其中B、C、D在常温下为气态,A为固体,W为含42个电子的离子化合物.它们满足如图的转化关系(反应条件略).
A、B、C和D均为短周期元素组成的非金属单质.其中B、C、D在常温下为气态,A为固体,W为含42个电子的离子化合物.它们满足如图的转化关系(反应条件略).

| ||
| 高温高压 |
| ||
| 高温高压 |
| ||
| ||
A、B、C、D、E、F、G七种物质间存在如图所示转化关系,其中A、B、D、G含有同种元素。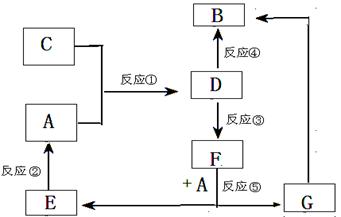
已知
(Ⅰ)A为金属单质; B为红褐色固体;E为密度最小的气体;G为浅绿色溶液。
(Ⅱ)D为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀。
(Ⅲ)D能将某种氧化物氧化为F,F是含有三种元素的化合物。
请回答下列问题:
(1)上述反应中属于置换反应的是 (填序号)。
(2)G生成B的过程中所出现的现象 ;
反应③的离子方程式 。
(3)D的水溶液显酸性,请用离子方程式解释原因 。
(4)实验室制取C的化学方程式为 ;
对气体C进行如下实验。已知整个反应过程中,每消耗0.1mol KI,转移的电子数约为3.612×1023 个。请按照要求填空:
| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 色 | (用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | (用化学方程式表示) |
A、B、C、D、E、F、G七种元素均是短周期元素,且原子序数依次增大。A原子无中子, B、G原子的最外层电子数均为其电子层数的两倍,D、G元素原子的最外层电子数相等。X、Y、Z、W、甲、乙六种物质均由上述元素的两种或三种元素组成,元素B形成的单质M与甲、乙(甲、乙是高中常见的浓酸)均能反应(相对分子质量甲< 乙)转化关系如图(反应条件略去),原子E最外层电子数和其电子层数相等。元素F形成的单质是 “21世纪的能源”,是目前应用最多的半导体材料。请回答下列问题:
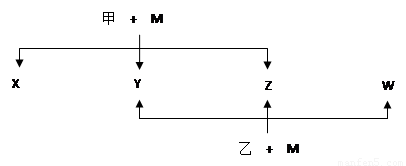
(1)A2D的熔沸点比A2G高的原因是 。B、D、G各一个原子构成每原子均满足8电子的分子,其电子式是 。
(2)E4B3和水反应的化学方程式 。
(3)写出M与甲的浓溶液加热时反应的化学方程式 。
(4)X、Y、Z、W属于同一类物质,这类化合物固态时的晶体类型为 ;X、Y、W都能与Z反应,则Z的结构式为 。
(5)已知CH4 (g)+ 2O2 (g)=CO2 (g)+2H2O (l) △H1=a kJ/mol
欲计算反应CH4 (g)+ 4NO (g)=2N2 (g)+CO2 (g)+2H2O (l)的焓变△H2 , 则还需要查找某化合反应的焓变△H3,当反应中各物质化学计量数之比为最简整数比时 △H3 = b kJ/mol,则该反应的热化学方程式为 。
据此计算出△H2 = kJ/mol(用含a和b的式子表示)。
已知:A为淡黄色固体,E、X常温下为气体,A、B、C、D含有相同的金属离子,其转化关系如右(部分产物已略去)。
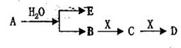
请回答下列问题:
(1) 常温常压下,3.9gA与足量的氷充分反应放出热量akJ,写出该反应的热化学方程式________
(2) 向500mL0.3mol/L的B溶液中缓慢通入2.24L(标准状况下)的气体X,则所得混合溶液中各离子浓度由大到小的顺序是________________
(3) 已知20°C时的溶解度:S(Na2CO3)=21.2g,S(NaHCO3)=9.6g。则20°C恒温条件下向121.2g饱和碳酸钠溶液中通入足量的CO2气体,理论上可以析出 NaHCO3 ________g (小数点后保留1位)
(4) 现有甲、乙两瓶无色溶液,已知它们可能是以下四种溶液:MgCl2溶液、 AlCl3溶液、NaOH溶液、氨水中的两种,现做如下实验:
①取440mL甲与120mL乙反应,产生1.56g白色沉淀M
②取440mL乙与120mL甲反应,也产生1. 56g白色沉淀M
③取120mL甲溶液与400mL乙溶液反应,则产生3.12g白色沉淀M;通过必要的计算和推理判定:甲溶液为__________溶液,乙溶液为________溶液。
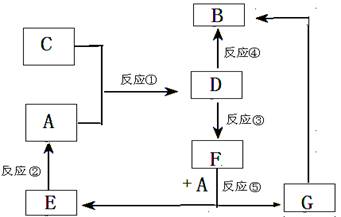
A、B、C、D、E、F、G七种物质间存在如图所示转化关系,其中A、B、D、G含有同种元素。
已知
(Ⅰ)A为金属单质; B为红褐色固体;E为密度最小的气体;G为浅绿色溶液。
(Ⅱ)D为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀。
(Ⅲ)D能将某种氧化物氧化为F,F是含有三种元素的化合物。
请回答下列问题:
(1)上述反应中属于置换反应的是 (填序号)。
(2)G生成B的过程中所出现的现象 ;
反应③的离子方程式 。
(3)D的水溶液显酸性,请用离子方程式解释原因 。
(4)实验室制取C的化学方程式为 ;
对气体C进行如下实验。已知整个反应过程中,每消耗0.1mol KI,转移的电子数约为3.612×1023 个。请按照要求填空:
|
实验步骤 |
实验现象 |
用化学用语解释 |
|
将少量气体通入淀粉KI溶液 |
溶液最初变成 色 |
(用离子方程式表示) |
|
继续通入气体 |
溶液逐渐变成无色 |
(用化学方程式表示) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com