
题目列表(包括答案和解析)
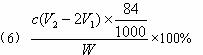
四种盐在不同温度下的溶解度(g/100 g水)表

(说明:①>35 ℃ NH4HCO3会有分解)
请回答以下问题:
(1)装置的连接顺序应是_________________________(填字母)。
(2)A装置中盛放的试剂是_________,其作用是____________________________________。
(3)在实验过程中,需要控制D温度在30—35 ℃,原因是___________________________。为了便于控制此温度范围,采取的加热方法为____________________________________。
(4)反应结束后,将锥形瓶浸在冷水中,析出NaHCO3晶体的原因是____________。用蒸馏水洗涤NaHCO3晶体的目的是除去___________________________杂质(以化学式表示)。
(5)将锥形瓶中的产物过滤后,所得的母液中含有______________(以化学式表示),可加入氯化氢,并进行_________操作,使NaCl溶液循环使用,同时可回收NH4Cl。
(6)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1—2滴酚酞指示剂,用物质的量浓度为c( mol·L-1)的HCl溶液滴定至溶液由红色到无色(指示![]() +H+====
+H+====![]() 反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:w(NaHCO3)=_________________。
反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:w(NaHCO3)=_________________。

四种盐在不同温度下的溶解度(g/
温度 溶解度 盐 | ||||||||
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | —① | — | — | — |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
(说明:①>
请回答以下问题:
(1)装置的连接顺序应是__________(填字母)。
(2)A装置中盛放的试剂是__________,其作用是__________。
(3)在实验过程中,需要控制D温度在30—
(4)反应结束后,将锥形瓶浸在冷水中析出NaHCO3晶体的原因是____________________
_____________________。用蒸馏水洗涤NaHCO3晶体的目的是除去____________杂质(以化学式表示)。
(5)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1—2滴酚酞指示剂,用物质的量浓度为c mol·L-1的HCl溶液滴定至溶液由红色到无色(指示![]() +H+
+H+![]()
![]() 反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定溶液由黄变橙,所用HCl溶液体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=_______________________________。
反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定溶液由黄变橙,所用HCl溶液体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=_______________________________。
我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出贡献.他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气和二氧化碳为原料制得NaHCO3,进而生产出纯碱.
(1)某研究性学习小组的同学,模拟“侯氏制碱法”提出下列三种制备NaHCO3的实验方案.经过讨论,大家一致认为方案2较合理,请说明方案3的不足之处是________.
方案1:分别将二氧化碳和氨气通入饱和食盐水中;
方案2:将二氧化碳通入含氨的NaCl饱和溶液;
方案3:将氨气通入含二氧化碳的NaCl饱和溶液中.
(2)根据方案2,某同学设计了如下实验步骤和装置图:

步骤1:配制含氨的饱和食盐水.在100 mL的锥形瓶中加入20 mL氨水(体积比1:1),再加入8 g食盐,塞紧橡皮塞,振荡几分钟,过滤除去不溶物,得到含氨的饱和食盐水.
步骤2:制备碳酸氢钠.按图组装实验装置,先检查装置的气密性,再向各仪器中加入相应的试剂,开始制备碳酸氢钠.实验过程中,需要控制温度在30℃-35℃(大于35℃时NH4HCO3会分解)和二氧化碳的通入速度(以出现能数得清的连续气泡为好).反应结束后,把锥形瓶浸入冷水中,使较多的晶体析出,过滤、洗涤.
请回答下列问题:
①为控制反应温度在30℃~35℃,应采用的操作方法是________.
②装置B中试剂是________,它的作用为________.
③装置C中的化学方程式为________.
④检验步骤2中所得晶体是碳酸氢钠而不是氯化钠的的实验方法和现象是________.
⑤请你设计一个简单的实验方案证明纯碱溶液呈碱性是由CO32-引起的.
答:________.
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,有NH4Cl晶体析出。……
请完成下列问题:
(1)装置的连接顺序是:(a)接( ) ( )接( );(b)接( )

(2)A中常选用的固体反应物为____________;D中应选用的液体为____________;B中发生反应的化学方程式为_________________________________________________________。
(3)第二步骤中必须先让_______________装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是____________________________________,C中广口瓶内产生固体的总化学方程式为______________________________________。
(5)第四步中分离出NH4Cl晶体的操作是___________________;其所得的NH4Cl晶体中常含有少量的NaCl和NaHCO3(约占5%—8%),请设计一个简单的实验证明所得固体的成分大部分是NH4Cl。简要写出操作和现象:______________________________________。
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,又有晶体析出,……
请回答下列问题:

(1)装置的连接顺序是:(a)接(_________)![]() (_________)接(_________);
(_________)接(_________);
(b)接(_________)。
(2)A中常选用的固体反应物为_________;D中应选用的液体为_________。
(3)B装置中分液漏斗内所加试剂为_________;第二步中必须先让_________装置发生反应。c中用球形干燥管而不用直导管,其作用是_________。
(4)第四步分离所得的晶体中含有多种成分,试证明其中含有NH4CI,简要写出操作过程和现象____________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com