
题目列表(包括答案和解析)
已知:2 CO(g) + O2(g) = 2CO2(g) △H=-566kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802kJ/mol
H2O(g)= H2O(l) △H=-44KJ/mol
则CH4在空气中不完全燃烧时,热化学方程式是
A.2CH4(g)+3.5O2(g)=CO2(g)+CO(g)+4H2O(g) △H=-1038kJ/mol
B.4CH4(g)+7O2(g)=2CO2(g)+2CO(g)+8H2O(l) △H=-2642kJ/mol
C.2CH4(g)+3.5O2(g)=CO2(g)+CO(g)+4H2O(g) △H=-1497kJ/mol
D.2CH4(g)+3.5O2(g)=CO2(g)+CO(g)+4H2O(l) △H=-1497kJ/mol
| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |

研究CO2与CH4,反应使之转化为CO和H2,对减缓燃料危机、减小温室效应具有重要的意义。
(1)已知:2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ/mol
则:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=____________。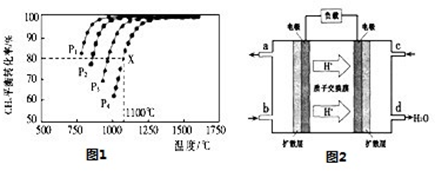
(2)在密闭容器中通人物质的量浓度均为0.1mol/L的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)=2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图1:
①下列事实能说明该反应一定达到平衡的是 。
a.CO2的浓度不再发生变化
b.υ正(CH4)=2υ逆(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO与H2的物质的量比为1:1
②据图可知,P1、P2、P3、P4由大到小的顺序为 。
③在压强为P4、1100℃的条件下,该反应5min时达到平衡x点,则用CO表示该反应的速率为 ,该温度下,反应的平衡常数为 。
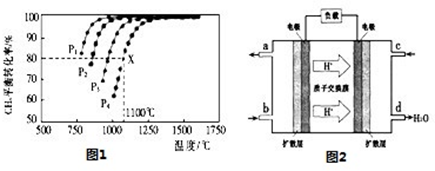
(3)用CO与H2可合成甲醇(CH3OH),以甲醇和氧气反应制成的燃料电池如图2所示,该电池工作程中O2应从 (填“c或一b”)口通人,电池负极反应式为 ,若用该电池电解精炼铜,每得到6. 4g铜,转移电子数目为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com