
题目列表(包括答案和解析)
(16分)Ⅰ.短周期元素X、Y、Z、W在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21。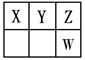
(1)写出W的简单离子的原子结构示意图 ;
氢元素与Z形成原子个数比为1∶1的化合物,其结构式为 。
(2)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是(用离子方程式表示) ;
(3)写出Y的最高价氧化物对应水化物的浓溶液与X在加热条件下反应的化学方程式
 ,
,
反应中每转移8mol 电子,消耗的还原剂质量为 g。
(4)写出能说明Y的非金属性比Z弱的一个实验事实:
Ⅱ.往1L体积不变的容器中加入0.200mol CO和1.00mol H2O(g),在t℃时反应:
CO+ H2O(g)  CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为 。
CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为 。
Ⅲ.甲醇燃料电池是一种相对理想的绿色能源,可用于电动汽车的电源;若该氢氧燃料电池以硫酸为电解质溶液,总反应为:2CH3OH + 3O2 = 2CO2+ 4H2O,则其正极的电极反应式

 CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO的转化率为________。
CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO的转化率为________。
 ,
, CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为 。
CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为 。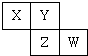 短周期元素X、Y、Z、W在元素周期表中的位置如下图所示,若W原子最外层电子数是其内层电子总数的
短周期元素X、Y、Z、W在元素周期表中的位置如下图所示,若W原子最外层电子数是其内层电子总数的| 3 |
| 5 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com