(2009?厦门二模)纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究.请填空:
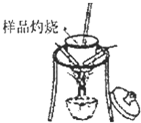
方案一:纯碱样品
测定剩余固体质量
(1)分别称取干燥坩埚和纯碱样品的质量,将纯碱样品放入坩埚中充分加热(如右图).坩埚中发生反应的化学方程式为:
.
(2)将坩埚置于干燥器中冷却后称量.实验时需要重复“加热、冷却、称量”操作多次,其目的是:
加热至恒重,以保证NaHCO3全部分解
加热至恒重,以保证NaHCO3全部分解
.
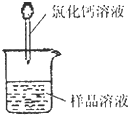
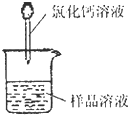
方案二:纯碱样品溶液
测定沉淀质量
(1)称取m
1g样品,置于小烧杯中,加水溶解.向小烧杯中滴加足量氯化钙溶液(如图).将反应混和物过滤后的下一步操作是:
洗涤沉淀
洗涤沉淀
.
(2)沉淀经干燥后称量为m
2g,则该样品中碳酸钠的质量分数为:
.
(3)如果用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,测得样品中的碳酸钠质量分数将比实际
不变
不变
(填“偏高”、“偏低”或“不变”).
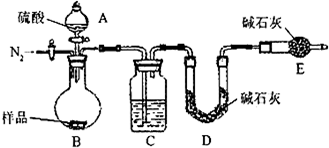
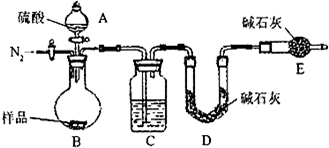
方案三:纯碱样品
测定生成二氧化碳的质量
(1)本实验采用vk图装置,C中盛放的物质是
浓硫酸
浓硫酸
.
(2)反应前后都要通入N
2,反应后通入N
2的目的是:
排尽装置内的空气,将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收
排尽装置内的空气,将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收

 (2009?厦门二模)纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究.请填空:
(2009?厦门二模)纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究.请填空:

 纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究.请填空:
纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究.请填空: 测定剩余固体质量
测定剩余固体质量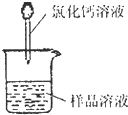
 测定沉淀质量
测定沉淀质量 测定生成二氧化碳的质量
测定生成二氧化碳的质量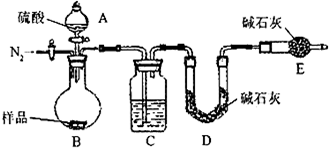
 测定剩余固体质量
测定剩余固体质量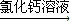 测定沉淀质量
测定沉淀质量 测定生成二氧化碳的质量
测定生成二氧化碳的质量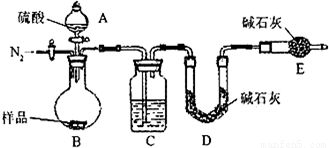

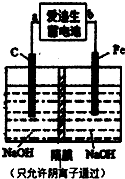 铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:
铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题: