
题目列表(包括答案和解析)
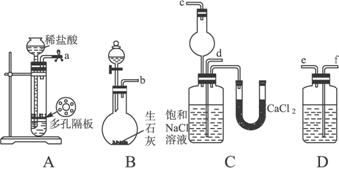
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,有NH4C1晶体析出……请回答下列问题:
(1)装置的连接顺序是:a接_______;_______接_______;b接_______。
(2)A中常选用的固体反应物为,D中应选用的液体为,B中发生反应的化学方程式为
_______________________________________________。
(3)第二步骤中必须先让_________________装置发生反应。
(4)C中用球形干燥管而不用直导管,其作用是________________________,C中广口瓶内产生固体的总化学方程式为_____________________________________________________。
(5)第四步中分离出NH4Cl晶体的操作是___________;所得的NH4Cl晶体中常含有少量的NaCl和NaHCO3约占5%—8%),请设计一个简单的实验证明所得固体的成分大部分是NH4Cl。简要写出操作和现象:_________________________________________________。
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,有NH4Cl晶体析出。……
请完成下列问题:
(1)装置的连接顺序是:(a)接( ) ( )接( );(b)接( )

(2)A中常选用的固体反应物为____________;D中应选用的液体为____________;B中发生反应的化学方程式为_________________________________________________________。
(3)第二步骤中必须先让_______________装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是____________________________________,C中广口瓶内产生固体的总化学方程式为______________________________________。
(5)第四步中分离出NH4Cl晶体的操作是___________________;其所得的NH4Cl晶体中常含有少量的NaCl和NaHCO3(约占5%—8%),请设计一个简单的实验证明所得固体的成分大部分是NH4Cl。简要写出操作和现象:______________________________________。
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,又有晶体析出,……
请回答下列问题:

(1)装置的连接顺序是:(a)接(_________)![]() (_________)接(_________);
(_________)接(_________);
(b)接(_________)。
(2)A中常选用的固体反应物为_________;D中应选用的液体为_________。
(3)B装置中分液漏斗内所加试剂为_________;第二步中必须先让_________装置发生反应。c中用球形干燥管而不用直导管,其作用是_________。
(4)第四步分离所得的晶体中含有多种成分,试证明其中含有NH4CI,简要写出操作过程和现象____________________。

四种盐在不同温度下的溶解度(g/
温度 溶解度 盐 | ||||||||
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | —① | — | — | — |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
(说明:①>
请回答以下问题:
(1)装置的连接顺序应是__________(填字母)。
(2)A装置中盛放的试剂是__________,其作用是__________。
(3)在实验过程中,需要控制D温度在30—
(4)反应结束后,将锥形瓶浸在冷水中析出NaHCO3晶体的原因是____________________
_____________________。用蒸馏水洗涤NaHCO3晶体的目的是除去____________杂质(以化学式表示)。
(5)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1—2滴酚酞指示剂,用物质的量浓度为c mol·L-1的HCl溶液滴定至溶液由红色到无色(指示![]() +H+
+H+![]()
![]() 反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定溶液由黄变橙,所用HCl溶液体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=_______________________________。
反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定溶液由黄变橙,所用HCl溶液体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=_______________________________。
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是____________(填标号)。
A.碳酸氢钠难溶于水
B.碳酸氢钠受热易分解
C.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
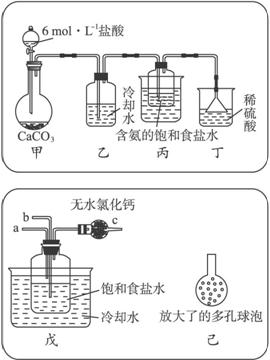
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是____________。
(Ⅱ)丁装置中稀硫酸的作用是__________________________________________________
____________________________________________________________________。
(Ⅲ)实验结束后,分离出NaHCO3晶体的操作是____________(填分离操作的名称)。
②另一位同学用图中戊装置(其他装置未画出)进行实验。
(Ⅰ)实验时,须先从____________管通入____________气体,再从____________管中通入____________气体。
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是____________。
(3)请你再写出一种实验室制取少量碳酸氢钠的方法:_______________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com