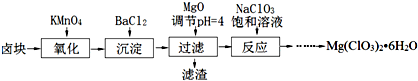
Ⅰ.无水氯化铝是某些有机化学反应中常用的催化剂,它的熔点190℃,但在180℃时已开始升华.它在常温下是一种白色固体,遇水发生剧烈的水解反应,甚至在空气中遇到微量水汽也强烈地发烟.用如图装置制取无水氯化铝:
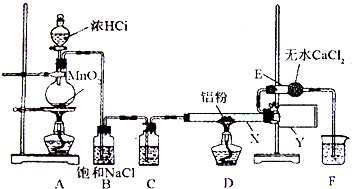
回答以下问题:
(1)装置D中发生的化学反应方程式:
.
(2)仪器X与仪器Y直接相连的意图是:①收集产物;②
防止堵塞
防止堵塞
.
(3)能否去掉E装置
不能
不能
原因是
防止E中水汽与AlCl3作用
防止E中水汽与AlCl3作用
.
(4)实验时应先点燃
A
A
处的酒精灯,其作用是
用氯气排尽装置中的空气以防产品不纯
用氯气排尽装置中的空气以防产品不纯
.
Ⅱ.某种胃药中止酸剂为CaCO
3.为测定其中CaCO
3的含量,某化学小组设计了以下方案(药片中的其他成分与HCl和NaOH溶液均不反应):
用滴定法测定,有以下几步操作:
A.配制0.100mol/L HCl溶液和0.100mol/L NaOH溶液
B.取一粒药片(0.100g),研碎后加入20.0mL蒸馏水
C.以酚酞为指示剂用0.100mol/L NaOH溶液滴定,用去NaOH溶液VmL时达到终点
D.用酸式滴定管加入25.00mL 0.100mol/L HCl溶液,充分反应
请回答有关问题:
(1)测定过程的正确操作顺序为
ABDC或BADC
ABDC或BADC
(填字母).
(2)经测定,每次消耗NaOH溶液体积的平均值为13.00mL,则该胃药中CaCO
3的质量分数是
60%
60%
%.