化学是一门以实验为基础的自然科学,掌握实验方法以及完成化学实验所必顺的技能是学好化学的关键.试回答下列实验问题:
(1)某同学认为MnO
2与浓HCl反应制得的Cl
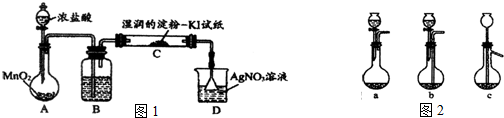
2中含有HCl气体,该同学设计如图1所示装量时行验证.
已知B中试剂为CCl
4,则:
①判定含有HCl气体的实验现象为:
C装置中淀粉碘化钾试纸不变色,D装置中有白色沉淀生成.
C装置中淀粉碘化钾试纸不变色,D装置中有白色沉淀生成.
.
②装置A中两仪器名称分别为:
分液漏斗
分液漏斗
、
烧瓶
烧瓶
.
③有人认为可将D装置溶液换成另一溶液,你认为可能为:
氢氧化钠溶液
氢氧化钠溶液
.
(2)某课外研究小组设计如图所示的实验过程,用石油化学工业的废气催化剂(主要成份为Ag/α-Al
2O
3)来回收金属银和α-Al
2O
3,部分操作过程省略.α-Al
2O
3作为催化剂的载体,且不溶于硝酸:
Ag/α-Al
2O
3 
①Ag/α-Al
2O
3加HNO
3溶解可选用图2所示装置中的
a
a
(选填a、b、c)
②实验操作II中,所需要的主要玻璃仪器有
漏斗、玻璃棒、烧杯
漏斗、玻璃棒、烧杯
.
③实验操作II中能否用自来水代替蒸馏水?
否
否
(填“能”或“否”)原因是
一般用自来水用氯气消毒,氯气和水反应生成盐酸和次氯酸Cl2+H2O=H++Cl-+HClO,盐酸和氧化铝反应生成氯化铝6 H++Al2O3=2Al3++3H2O,导致回收的氧化铝的质量减少,所以不能用自来水代替蒸馏水.
一般用自来水用氯气消毒,氯气和水反应生成盐酸和次氯酸Cl2+H2O=H++Cl-+HClO,盐酸和氧化铝反应生成氯化铝6 H++Al2O3=2Al3++3H2O,导致回收的氧化铝的质量减少,所以不能用自来水代替蒸馏水.
(结合有关离子方程式给以必要的文字说明)
④操作I中所发生的离子反应方程式:
Ag+NO3-+2H+=3Ag++NO↑+H2O
Ag+NO3-+2H+=3Ag++NO↑+H2O
.