某教师在上《元素周期表》复习课时,组织了一个“介绍自己”的活动:

我们班级中共有44位同学,分为8个小组,按从左到右分别为IA、IIA…VIIA、0族,从上到下分别为第一、二…六周期.座位上的每一位同学对应一种元素,请在下列问题中符合要求的同学向大家介绍自己.
请你一起思考并回答下列问题:
(1)第三周期IVA族的元素对应座位号是
16
16
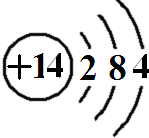
,原子结构示意图为
.
(2)座位号为22的元素在元素周期表中的位置是
第四周期第IIA族
第四周期第IIA族
.
(3)比较座位号为18、19对应的元素的非金属性强弱,请用离子方程式表示
Cl2+S2-=S↓+2Cl-或Cl2+H2S=2H++S↓+2Cl-
Cl2+S2-=S↓+2Cl-或Cl2+H2S=2H++S↓+2Cl-
.
(4)课堂中有学生提出,这样的安排会导致他们没有对应的元素,则学生对应的座位号是
2,3
2,3
.

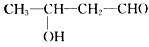
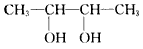
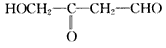
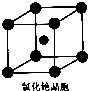 《物质结构与性质》
《物质结构与性质》