
题目列表(包括答案和解析)
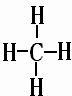 、
、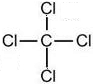 (任写两种)
(任写两种)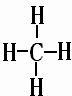 、
、 (任写两种)
(任写两种)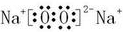
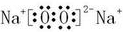
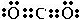
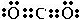
| ||
| ||
| 1H 氢 |
 |
2He 氦 | ||||||
| 3Li 锂 |
4Be 铍 |
5B 硼 |
6C 碳 |
7N 氮 |
8O 氧 |
9F 氟 |
10Ne 氖 | |
| llNa 钠 |
12Mg 镁 |
13A1 铝 |
14Si 硅 |
15P 磷 |
16S 硫 |
XC1 氯 |
18Ar 氩 | |
| 19K 钾 |
20Ca 钙 |
… | ||||||
在元素周期表中处于相邻位置的元素在结构和性质上有许多相似的地方。第二周期的碳、氮、氧、氟都可以形成氢化物,氧元素的氢化物除H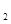 O外,还有H
O外,还有H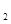 O
O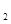 ;碳元素的氢化物除CH
;碳元素的氢化物除CH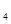 外,还有C
外,还有C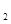 H
H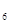 等;与之相似的氮元素的氢化物除外,还有N
等;与之相似的氮元素的氢化物除外,还有N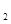 H
H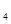 等。
等。
(1)碳原子之间可以结合成链状结构,氮原子之间也可以形成链状结构,假设氮原子间只以氮氮单键形式连接成链状,并形成氢化物,则该系列氢化物的通式为 。
(2)该系列中的N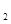 H
H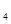 是“神六”发射时火箭所用的液体燃料,液态的四氧化二氮作氧化剂,此液态燃料的优点是产生的能量大且无污染。已知40g N
是“神六”发射时火箭所用的液体燃料,液态的四氧化二氮作氧化剂,此液态燃料的优点是产生的能量大且无污染。已知40g N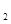 H
H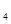 在火箭发射时反应中放出710kJ热量,写出火箭发射时该反应的热化学方程式:
。
在火箭发射时反应中放出710kJ热量,写出火箭发射时该反应的热化学方程式:
。
(3)该系列物中的NH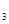 对农业、化学、国防工业具有重要意义。其合成原理为:
对农业、化学、国防工业具有重要意义。其合成原理为:
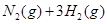


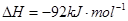
I.在一定温度下,将1.5molN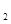 和6 molH
和6 molH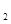 通入到一个固定容积为VL的密闭容器中,当反应达到平衡时,容器内气体的压强为起始时的80%,则
通入到一个固定容积为VL的密闭容器中,当反应达到平衡时,容器内气体的压强为起始时的80%,则
此时反应放出的热量为 kJ.
H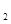 的转化率= 。
的转化率= 。
该温度下合成氨反应的平衡常数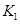 =
(只列数字表达式)
=
(只列数字表达式)
II.在保持温度不变,相同体积的密闭容器中,将起始的物质的量改为amolN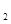 、bmolH
、bmolH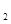 、cmolNH
、cmolNH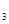 ,平衡时NH
,平衡时NH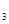 的物质的量分数为25%,则:
的物质的量分数为25%,则:
达到平衡时,I和II放出的热量 (填字母代号)
A。一定相等
B。前者一定小于后者
C。前者等于或小于后者
D。前者等于或大于后者
I和II合成氨的平衡常数分别为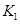 和
和 ,同
,同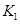
 (填“﹥”、“﹤”或
“=”)
(填“﹥”、“﹤”或
“=”)
欲使开始时反应正向进行,a的取值范围为 。
已知丙氨酸的结构简式为: ,根据题意完成第23~26题:
,根据题意完成第23~26题:
23.丙氨酸中涉及到四种元素,它们的原子半径由小到大的顺序为 。
24.丙氨酸分子属于 (填“极性”或“非极性”)分子,一个丙氨酸分子中含有
个非极性共价键。
25.丙氨酸分子中的氮原子核外有 个未成对电子,有 种不同能量的电子。
26.碳、氮、氧都可以形成氢化物,氧元素的氢化物除H2O外,还有H2O2,碳元素的氢化物除CH4外,还有C2H6等。与之相似的氮元素的氢化物的除NH3外,还有________,该氢化物与足量盐酸反应的化学方程式为______________________ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com