
题目列表(包括答案和解析)


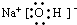
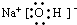
 H++HO2ˉ
H++HO2ˉ H++HO2ˉ
H++HO2ˉ| c2(SO3) |
| c(O2)?c2(SO2) |
| c2(SO3) |
| c(O2)?c2(SO2) |
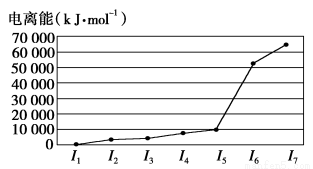
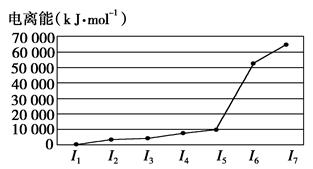
A、B、C、D、E五种元素,A元素的周期数、主族数、原子序数相同;B的基态原子核外有3种能量不同的原子轨道,且每种轨道中的电子数相同;C元素的电离能如图所示;D元素的价电子构型为nsnnpn+2;E是第4周期的过渡元素,血红蛋白中的E元素与BD形成的配位键比与D2形成的配位键强。E单质与BD形成的配合物E(BD)5,常温下呈液态,熔点为-20.5℃,沸点为103 ℃,易溶于非极性溶剂。
C元素的电离能
(1)E(BD)5晶体属于________(填晶体类型)。
(2)A元素和B元素组成的化合物分子之间________(填“能”或“不能”)形成氢键。
(3)基态E原子的电子排布式为___________________________________ 。
(4)B、C、D三种元素的电负性由大到小的顺序是________(填元素符号)。
(5)C2和B2A2的分子中根据电子云重叠的方式不同,都包含的共价键类型有________。
(6)已知原子数和电子数相同的微粒叫等电子体,等电子体的结构相似。根据
下表数据,说明BD分子比C2分子活泼的原因_____________________________。
| X—Y | X=Y | X≡Y |
BD的键能/kJ·mol-1 | 357.7 | 798.9 | 1 071.9 |
C2的键能/kJ·mol-1 | 154.8 | 418.4 | 941.7 |
| | X—Y | X=Y | X≡Y |
| BD的键能/kJ·mol-1 | 357.7 | 798.9 | 1 071.9 |
| C2的键能/kJ·mol-1 | 154.8 | 418.4 | 941.7 |
| 元素 | 原子结构或性质 | ||
| A | 原子最外层电子数是内层电子总数的
| ||
| B | 形成化合物种类最多的元素,其单质为固体 | ||
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 | ||
| D | 地壳中含量最多的元素 | ||
| E | 与D同主族 | ||
| F | 与E同周期,且最外层电子数等于电子层数 |


| ||
| ||
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com