
题目列表(包括答案和解析)
在一个盛有催化剂溶剂可变的密闭容器中,保持一定温度和压强进行以下反应:
N2+3H2![]() 2NH3。已知加入1molN2和4molH2时,达到平衡后生成amolNH3(见下表的“已知”项)。在相同温度、压强下,保持平衡时各组分的体积分数不变。对下列编号(1)-(3)的状态,填写表中的空白。
2NH3。已知加入1molN2和4molH2时,达到平衡后生成amolNH3(见下表的“已知”项)。在相同温度、压强下,保持平衡时各组分的体积分数不变。对下列编号(1)-(3)的状态,填写表中的空白。
| 编号 | 起始量 | 起始量 | 起始量 | 平衡量 |
| N2 | H2 | NH3 | NH3 | |
| 已知 | 1 | 4 | 0 | a |
| (1) | 1.5 | 6 | 0 | |
| (2) | 1 | 0.5a | ||
| (3) | m | g(g>4m) |
某学生在A、B、C、D四只小烧杯中分别放入干燥的细铁丝、漫过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝(并使铁丝完全浸没在食盐水中)。然后装配成如下图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示:
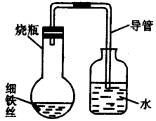
时间/小时 0 0.5 1.0 1.5 2.0 2.5 3.0
A瓶(盛干燥铁丝) 0 0 0 0 0 0 0
B瓶(盛沽了食盐水的铁丝) 0 0.4 1.2 3.4 5.6 7.6 9.8
C瓶(盛沾了清水的铁丝) 0 0 0 0.3 0.8 2.0 3.5
D瓶(盛完全浸没在食盐水中的铁丝) 0 0 0 0 0 0 0
(1)为什么有的导管中水面上升?________。
(2)上述实验中,铁生锈的速率由大到小的排列顺序为(填小烧杯的字母编号)________。
(3)影响铁生锈的因素除氧气外还有________。
(4)日常生活中常见到铁制品生成铁锈,试写出铁生成铁锈(Fe2O3·XH2O)的化学方程式________。
(5)通过上面的研究,你认为在日常生活中应该如何保护铁锅等制品?________。
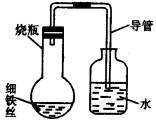
时间/小时 0 0.5 1.0 1.5 2.0 2.5 3.0
A瓶(盛干燥铁丝) 0 0 0 0 0 0 0
B瓶(盛沽了食盐水的铁丝) 0 0.4 1.2 3.4 5.6 7.6 9.8
C瓶(盛沾了清水的铁丝) 0 0 0 0.3 0.8 2.0 3.5
D瓶(盛完全浸没在食盐水中的铁丝) 0 0 0 0 0 0 0
(1)为什么有的导管中水面上升?________。
(2)上述实验中,铁生锈的速率由大到小的排列顺序为(填小烧杯的字母编号)________。
(3)影响铁生锈的因素除氧气外还有________。
(4)日常生活中常见到铁制品生成铁锈,试写出铁生成铁锈(Fe2O3·XH2O)的化学方程式________。
(5)通过上面的研究,你认为在日常生活中应该如何保护铁锅等制品?________。
 和
和 充入一个容积固定的密闭容器中,发生反应
充入一个容积固定的密闭容器中,发生反应 .当反应达到平衡时为n mol.在与上述完全相同的容器中,保持温度不变,若平衡时仍为n mol,则下列组合中不正确的是
.当反应达到平衡时为n mol.在与上述完全相同的容器中,保持温度不变,若平衡时仍为n mol,则下列组合中不正确的是  2
2 
二氧化钛是一种不溶于稀酸的物质,常用于制取金属钛。某种金红石矿石的主要成分是TiO2,含有Fe2O3和Al2O3杂质。一研究性学习小组设计如下方案制备金属钛,并得到其它副产品。

(1)已知Fe(OH)3、Al(OH)3,开始沉淀的pH数据(见下表)
氢氧化物 | Fe(OH)3 | A1(OH)3 |
开始沉淀pH | 1.5 | 3.3 |
向溶液I中滴加NaOH溶液,并调溶液pH,若开始只得到一种沉淀,该沉淀是 ,应控制pH的范围是 ,反应的离子方程式是 ;
(2)向溶液Ⅱ中“继续加适量NaOH溶液”,若操作不当会减少滤渣Ⅲ的质量,请你设计另一种方案代替向溶液Ⅱ中“继续加适量NaOH溶液”的方案,该方案是 ,反应的离子方程式是 ;
(3)已知:①CO2(g)==C(s)+O2(g); △H =393.5 kJ?mol-l
②CO(g)+ O2(g)==CO2(g); △H =-283 kJ?mol-l
③TiO2(s)+2Cl2(g)==TiCl4(s)+O2(g);△H =141 kJ?mol-l
写出TiO2与Cl2+C反应的热化学方程式 。
(4)若经过多步反应后制得b g金属钛,则金红石矿石中TiO2的质量分数为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com