
题目列表(包括答案和解析)
|
下列变化为放热的化学反应的是 | |
| [ ] | |
A. |
H2O(g)=H2O(l) ΔH=-44.0 kJ/mol |
B. |
2HI(g)=H2(g)+I2(g) ΔH=+QkJ/mol(Q>0) |
C. |
形成化学键时共放出 862 kJ能量的化学反应 |
D. |
C(金刚石,s)=C(石墨,s) ΔH=-Q(Q>0) |
| |||||||||||||||
| |||||||||||||||||||
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g/cm3,溶质的质量分数为w,溶质的物质的量浓度为c mol/L。下列叙述中正确的是( ) ( )
①w=![]() ×100% ②c=
×100% ②c=![]() ③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 w
③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 w
A.①③ B.②③ C.①② D.只有②
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制取碱式碳酸镁的实验步骤如下
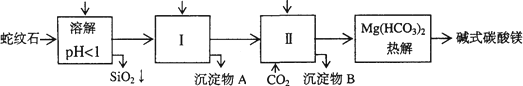
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是________
(2)进行Ⅰ操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见下表)
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致________溶解、________沉淀.
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入________(填入物质的化学式),然后________(依次填写实验操作名称).
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是________(填写物质化学式).
(5)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量
②高温分解
③________
④________
⑤MgO称量
(6)18.2 g产品完全分解后,产生6.6 g CO2和8.0 g MgO,由此可知,产品的化学式中:a=________ b=________ c=________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com