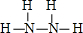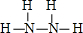依据事实,写出下列反应的热化学方程式.
(1)已知:
Fe(s)+
O
2(g)=FeO(s)△H=-272.0kJ?mol
-12Al(s)+
O
2(g)=Al
2O
3(s)△H=-1675.7kJ?mol
-1Al和FeO发生铝热反应的热化学方程式是
2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ?mol-1
2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ?mol-1
.
(2)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,若1g水蒸气转化成液态水时放热2.444KJ,试写出氢气燃烧生成液态水的热化学方程式
2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ?mol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ?mol-1
(3)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N
2与H
2反应生成NH
3的热化学方程式为
N2(g)+3H2(g)═2NH3(g)△H=-92kJ?mol-1
N2(g)+3H2(g)═2NH3(g)△H=-92kJ?mol-1
.

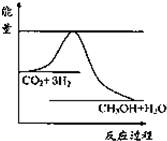 (1)一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.关于该反应的下列说法中,正确的是
(1)一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.关于该反应的下列说法中,正确的是