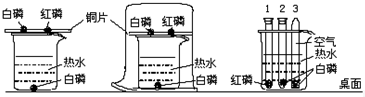
小琴同学设计如图所示的A、B两个实验.她事先除去了金属片表面的氧化物或污物.
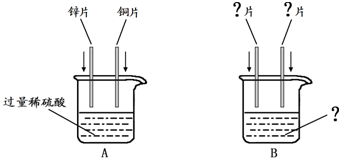
(1)A实验中,为了比较锌、铜的金属活动性强弱,将锌片和铜片同时插入过量的稀硫酸中,所发生反应的化学方程式为
Zn+H2SO4═ZnSO4+H2↑
Zn+H2SO4═ZnSO4+H2↑
.
(2)B实验中,为了验证锌、铜、银三种金属活动性强弱,两种金属片分别是
锌片(或Zn)
锌片(或Zn)
和
银片(或Ag)
银片(或Ag)
,烧杯内盛放的溶液是过量的
CuSO4[或Cu(NO3)2或CuCl2溶液或用名称表达]
CuSO4[或Cu(NO3)2或CuCl2溶液或用名称表达]
溶液.
(3)为了验证锌、铁的金属活动性强弱,小琴同学将锌片和铁片同时插入A实验后的剩余溶液中,而没有插入B实验后的剩余溶液中,其原因是
将锌片、铁片放入A中,与实验后剩余溶液中过量的硫酸反应,锌片放出气泡速度比铁片快,得出锌比铁活泼;若将锌片、铁片放入B中,与实验后剩余溶液中过量的硫酸铜都反应,锌铁表面都生成红色固体(或锌铁的现象都相同),且无法判断铁是否与硫酸锌反应,所以不能比较锌铁的活动性强弱
将锌片、铁片放入A中,与实验后剩余溶液中过量的硫酸反应,锌片放出气泡速度比铁片快,得出锌比铁活泼;若将锌片、铁片放入B中,与实验后剩余溶液中过量的硫酸铜都反应,锌铁表面都生成红色固体(或锌铁的现象都相同),且无法判断铁是否与硫酸锌反应,所以不能比较锌铁的活动性强弱
.