
题目列表(包括答案和解析)
已知G、Q、X、Y、Z均为氯的含氧化合物。我们不了解它们的化学式,但知道它们在一定条件下具有下列转化关系(未配平):
①G→Q+NaCl
②Q+H2O→(电解)X+H2
③Y+NaOH→G+Q+H2O
④Z+NaOH→Q+X+H2O
这五种化合物中氯的化合价由低到高的顺序是……( )
A、GYQZX B、XZQGY C、XZQYG D、GQYZX
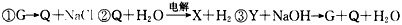
|
G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转换关系(未配平)(已知氯有如下化合价-1、+1、+3、+5、+7): ①G→Q+NaCl ②Q+H2O ③Y+NaOH→G+Q+H2O ④Z+NaOH→Q+X+H2O 这五种化合物中氯的化合价由低到高的顺序为 | |
| [ ] | |
A. |
QGZYX |
B. |
GYQZX |
C. |
GYZQX |
D. |
ZXGYQ |
①Y+NaOH→G+Q+H2O
②Z+NaOH→Q+X+H2O
③Q+H2O![]() X+H2↑
X+H2↑
④G→Q+NaCl
由以上各反应可判断:
(1)这五种化合物中,氯元素价态由低到高的顺序为:_______________________.
(2)由反应③可以看出Q、X中氯元素价态高低顺序,其依据是__________________.
(3)臭氧(O3)与二氧化氯作用,可得到红色油状的六氧化二氯(Cl2O6),遇到有机物时会爆炸.它与碱溶液作用可得到等物质的量的氯的两种含氧酸盐,代表该反应的是(填①~④编号)________,其离子方程式是__________________.
(4)亚氯酸盐(如NaClO2)可用作漂白剂,在常温下不见光时可保存约1年.但在酸性溶液中因生成亚氯酸而发生分解:5HClO2====4ClO2+H++Cl-+2H2O.分解时,刚加入硫酸时反应缓慢,随后突然反应迅速,释放出气态的二氧化氯,这是因为________(填序号).
①酸性亚氯酸的氧化性增强
②溶液中H+起催化作用
③溶液中Cl-起催化作用
④逸出ClO2使反应的生成物浓度降低
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com