A、B、C、D、E五种短周期元素,核电荷数依次增加,其中B的最外层电子数是内层电子总数的2倍,它们可形成含有非极性键的B
2A
2、A
2C
2、D
2C
2的化合物;E的单质在自然界中常在火山喷口附近出现.据此回答下列问题:
(1)写出D
2C
2的电子式:
(2)我国普遍采用一种方法制得含有A、C、E三种元素的某重要化工产品,其工业生成的第一步化学反应方程式为
.
(3)均由A、C、D、E四种元素组成的两种物质在溶液中反应的离子方程式为
H++HSO3-=H2O+SO2↑
H++HSO3-=H2O+SO2↑
.
(4)由A与C两种元素组成的一种化合物能使酸性高锰酸钾褪色,反应的离子方程式是
2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
.
(5)单质B可与由A、C、E 三种元素组成的化合物在一定条件下反应生成EC
2,该反应的化学方程式为
C+2H
2SO
4(浓)
CO
2↑+2SO
2↑+2H
2O
C+2H
2SO
4(浓)
CO
2↑+2SO
2↑+2H
2O
.
(6)B元素的氢化物有多种,1molB的某种氢化物中含有14mol电子,已知在25℃,101kPa下,1g该气态氢化物在足量氧气中完全燃烧生成液态水时放出热量为50kJ,写出该物质燃烧热的热化学方程式
C
2H
2(g)+
O
2(g)=2CO
2(g)+H
2O(l)△H=-1300kJ/mol
C
2H
2(g)+
O
2(g)=2CO
2(g)+H
2O(l)△H=-1300kJ/mol
.

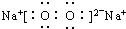
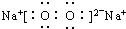
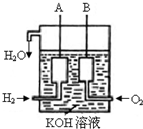 已知在25°C、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题:
已知在25°C、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题: