
题目列表(包括答案和解析)
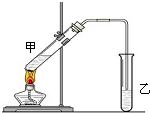 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:| 实验操作与预期现象 | 实验结论 | 判断理由 | |
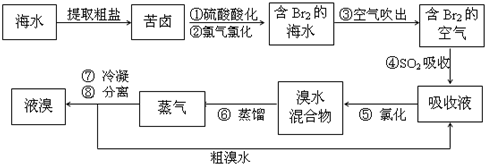
| 步骤一 | 用pH计测得混合液的pH=9.82 | ① CO32-和SO32-可能存在 CO32-和SO32-可能存在 |
因为它们水解显碱性 |
| 步骤二 | HCl 后,生成无色无味气体. | ② 肯定存在CO32-离子,不存在SO32- 肯定存在CO32-离子,不存在SO32- |
③ 因为CO32-+2H+=CO2↑(无色无味)+H2O,SO32-+2H+=SO2↑(具有刺激性气味) 因为CO32-+2H+=CO2↑(无色无味)+H2O,SO32-+2H+=SO2↑(具有刺激性气味) |
| 步骤三 | 在步骤二反应后溶液中加 CCl4, 滴加少量氯水,振荡后,CCl4层未变色; |
肯定不存在Br-、I- | ④ 因为加氯水后,CCl4层没有溴和碘的颜色出现 因为加氯水后,CCl4层没有溴和碘的颜色出现 |
| 步骤四 | ⑤ 在步骤三反应后溶液中加BaCl2溶液产生白色沉淀,分离,在沉淀中加人足量盐酸,沉淀不能完全溶解 在步骤三反应后溶液中加BaCl2溶液产生白色沉淀,分离,在沉淀中加人足量盐酸,沉淀不能完全溶解 |
肯定存在SO42- | 因为BaSO4不溶于盐酸. |
| 步骤五 | 在步骤四反应后溶液中加 HNO3 酸化后,再加过量 AgNO3,溶液中析出白色沉淀. | 不能确定Cl-是否存在 | ⑥ 因为在前面实验中加入盐酸和氯水 因为在前面实验中加入盐酸和氯水 |
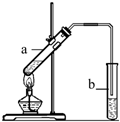 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题: CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com