
题目列表(包括答案和解析)
已知理想气体各参数p(压强)、V(体积)、T(温度)、n(物质的量)满足理想气体状态方程pV=nRT。某学校课外活动小组粗略测定理想气体状态方程中气体常数R的值,下面是测定实验的分析报告,请填写有关空白:
(一)测定原理:在理想气体状态方程pV=nRT中,气体常数R=pV/nT的数值可以通过实验来确定。本实验通过金属镁置换出盐酸中的氢来测定R的值。其反应为:
Mg+2HCl=MgCl2+H2↑
如果称取一定质量的镁与过量的盐酸反应,则在一定温度和压力下,可以通过测出反应放出氢气的体积。实验室的温度和压力可以分别由温度计和气压计测得。氢气物质的量可以通过反应中镁的质量来求得。将以上所得各项数据代入R= pV /nT式中,即可算出R值。
 (二)实验用品及试剂:①仪器:托盘天平、测定气体常数的装置(如上图所示);②试剂:6mol·L-1HCl、镁条若干。
(二)实验用品及试剂:①仪器:托盘天平、测定气体常数的装置(如上图所示);②试剂:6mol·L-1HCl、镁条若干。
(三)实验内容:
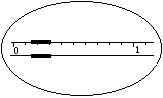
1.在托盘天平上称出镁条的质量(称量镁条天平的游码示数如右图所示,未用砝码,单位为g);
2.按上图搭好仪器。取下试管,移动量气管B,使量气管A中的水面略低于零刻度线,然后将量气管B固定。
3.在试管中加入15mL 6 mol·L-1HCl,不要使盐酸沾湿试管的上半部。将已称重的镁沾少许水,贴在试管上部不与盐酸接触。
4.检查仪器是否漏气,方法如下:(方法要求简单有效)
。
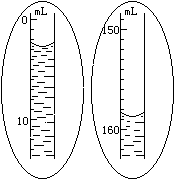 5.如果装置不漏气,调整量气管B的位置,使量气管A内水面与量气管B 内水面在同一水平面上(要求“在同一水平面上”的原因是 ;实现“在同一水平面上”的操作是 ),然后准确读出量气管A内水面凹面最低点的读数V1(如右图所示)。
5.如果装置不漏气,调整量气管B的位置,使量气管A内水面与量气管B 内水面在同一水平面上(要求“在同一水平面上”的原因是 ;实现“在同一水平面上”的操作是 ),然后准确读出量气管A内水面凹面最低点的读数V1(如右图所示)。
6.轻轻摇动试管,使镁条落入盐酸中,镁条与盐酸反应放出氢气。此时量气管A内水面即开始下降。为了不使量气管A内气压增大而造成漏气,在量气管A内水面下降的同时,慢慢 (上或下)移量气管B,使两管内的水面基本保持水平。反应停止后,待试管冷却至室温(约10分钟),移动量气管B,使两管内的水面相平,读出反应后量气管A内的精确读数V2(如右图所示)。
7.记录实验时的室温t和大气压P。(已知室温为27℃,大气压为100kPa)
(四)数据记录与处理(在横线上填写适当内容):
| 镁条的质量 | w= |
| g |
| 氢气的物质的量 | n= |
| mol |
| 反应前量气管A内读数 | V1= |
| ml |
| 反应后量气管A内读数 | V2= |
| ml |
| 氢气的体积 | V |
| ml |
| 室温 | T |
| K |
| 大气压 | P |
| Pa |
气体常数R的值(计算过程和结果):
(五)问题与讨论:①在读取量气管内气体体积V1时,眼睛仰视读数,结果造成R的测定值 (偏高、偏低或无影响);②若没等反应试管冷却到室温就量取液面的高度,结果造成R的测定值 (偏高、偏低或无影响)。
在两个密闭容器中,分别充有质量相等的甲乙两种气体。若两容器的温度和压强均相等,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多 B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小 D.甲的相对分子质量比乙的相对分子质量小
【解析】由理想气体状态方程PV=nRT可知,当两容器的温度和压强均相等时,气体的体积V与气体的物质的量n成正比,又因为甲的密度大于乙的密度,而甲、乙两种气体的质量相等,故甲气体的体积小于乙气体的体积,甲的物质的量小于乙的物质的量,故B正确,A、D不正确;因为两容器的温度和压强均相等,所以甲乙两气体的摩尔体积也相等,故C也不正确。
在两个密闭容器中,分别充有质量相等的甲乙两种气体。若两容器的温度和压强均相等,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多 B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小 D.甲的相对分子质量比乙的相对分子质量小
【解析】由理想气体状态方程PV=nRT可知,当两容器的温度和压强均相等时,气体的体积V与气体的物质的量n成正比,又因为甲的密度大于乙的密度,而甲、乙两种气体的质量相等,故甲气体的体积小于乙气体的体积,甲的物质的量小于乙的物质的量,故B正确,A、D不正确;因为两容器的温度和压强均相等,所以甲乙两气体的摩尔体积也相等,故C也不正确。
 将A与B的混合气体分别置于恒压容器甲和恒容容器乙中,发生如下反应:2A(g)+2B(g)?3C(g);△H<0.下列说法不正确的是( )
将A与B的混合气体分别置于恒压容器甲和恒容容器乙中,发生如下反应:2A(g)+2B(g)?3C(g);△H<0.下列说法不正确的是( )| A、在相同条件下两容器内的反应均达到化学平衡状态,升温时甲、乙两容器中反应速率均增大 | B、在相同条件下两容器内的反应均达到化学平衡状态,升温时甲乙两容器中的平衡均向逆方向移动 | C、在相同温度下,甲容器中加入2molA和2molB,乙容器中加入3molC,若甲容器经30s达到平衡状态,则乙容器达到平衡时所需要的时间也是30s | D、在相同的温度和压强下,用甲容器分别进行反应.第一次加入2molA和2molB;第二次加入2molA.2molB和3molC;第三次加入4molC.分别达到化学平衡状态时,C的物质的量百分含量分别为X、Y、Z.则X、Y、Z的大小关系是X=Y=Z |
| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com