
题目列表(包括答案和解析)
Cr2O![]() +H2O
+H2O![]() 2HCrO
2HCrO![]() HCrO
HCrO![]()
![]() H++CrO
H++CrO![]()
已知Na2Cr2O7和Na2SO4的溶解度曲线如下图所示。为把含有少量Na2SO4的Na2Cr2O7晶体提纯,可采取以下方法:①趁热过滤;②用降温法结晶分离出Na2Cr2O7;③加适量水将含有少量杂质的Na2Cr2O7溶解成饱和溶液;④加热至100 ℃以上蒸发收缩;⑤加稀H2SO4酸化。

(1)操作步骤的正确顺序是(填序号)____________________________。
(2)用稀H2SO4酸化的目的是__________________________________________。
(3)趁热过滤的目的是__________________________________________。
Na2Cr2O7的水溶液中存在下列平衡: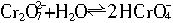 ,
,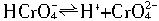 .已知Na2Cr2O7和Na2SO4的溶解度曲线如下图所示,可采用以下方法将Na2Cr2O7中混有的Na2SO4除去:①趁热过滤 ②用降温法析出晶体,分离出Na2Cr2O7 ③加适量水将含有少量杂质的Na2Cr2O7溶解成饱和溶液 ④加热至100℃以上蒸发浓缩 ⑤加稀H2SO4酸化。
.已知Na2Cr2O7和Na2SO4的溶解度曲线如下图所示,可采用以下方法将Na2Cr2O7中混有的Na2SO4除去:①趁热过滤 ②用降温法析出晶体,分离出Na2Cr2O7 ③加适量水将含有少量杂质的Na2Cr2O7溶解成饱和溶液 ④加热至100℃以上蒸发浓缩 ⑤加稀H2SO4酸化。
(1)实现上述目的的操作步骤的正确顺序是___(填序号)。
(2)用稀H2SO4酸化的目的是_______。
(3)趁热过滤的目的是____________。
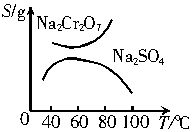

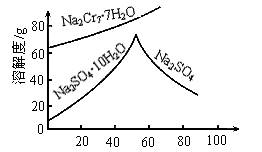
重铬酸钠的水溶液中存在如下平衡:Cr2O72-+H2Oƒ2HCrO4-ƒ2H++2CrO42-,重铬酸钠和硫酸钠随温度变化,溶解度变化如图所示。现可供选择的试剂是:硝酸、盐酸、硫酸及pH试纸。简述固体Na2Cr2O7中含有少量Na2SO4,怎样用简便方法除去杂质Na2SO4?
 (2012?河西区二模)A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大.A元素的原子半径最小,与E同主族,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐X,D与E可形成淡黄色固体Y,F元素原子的最外层电子数比次外层电子数少1.请按要求回答下列问题:
(2012?河西区二模)A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大.A元素的原子半径最小,与E同主族,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐X,D与E可形成淡黄色固体Y,F元素原子的最外层电子数比次外层电子数少1.请按要求回答下列问题: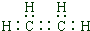
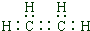
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com