
题目列表(包括答案和解析)
一定温度下,将3 mol A气体和1 mol B气体通人一密闭容器中,发生如下反应:3A(g)+B(g)![]() nC(g).请填写下列空白:
nC(g).请填写下列空白:
(1)
若容器体积固定为2 L,2 min时测得剩余0.6 mol B,C的浓度为0.4 mol·L-1.①2 min内,A的平均反应速率为________;n=________;
②若反应从起始经4 min达到平衡,平衡时C的浓度________0.8 mol/L(填“>”、“<”或“=”);假设此时C的体积分数为x%
③若改变起始物质加入的量,欲使反应达到平衡时C的体积分数仍为x%,则起始加入的A、B、C三种物质的物质的量a、b、c之间应该满足的关系式为________、________.(分别用含a、c和含b、c的两个式子表示)
(2)
若维持容器压强不变:其它条件均与题(1)相同①此时达到平衡时C的体积分数为y%,则比较x________y(填“>”、“<”、“=”);
②改变起始物质加入的量,欲使反应达到平衡时C的体积分数仍为y%,则起始加入的A、B、C三种物质的物质的量a、b、c之间应该满足的关系式为________.
| 时间(s) n(mol) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |

| 时间(s) n(mol) | 20 | 40 | 60 | 80 | 100 | |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
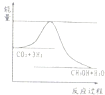
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mo1/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/moI/L | 0.010 | 0.010 | 0.020 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com