
题目列表(包括答案和解析)
如下图装置,A、B中电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹,电源a、b两极。若在A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,闭合K2、K3通直流电, 电解一段时间后A、B中均有气体如图所示。
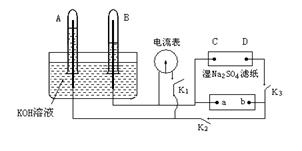
(1)电源的a极为 (填正、负极)。
(2)在湿的Na2SO4滤纸条中心滴KMnO4液滴,现象是 。
(3)写出A中电极反应式 。
(4)若电解一段时间后A、B中均有气体包围电极。此时切断K2、K3,闭合K1电流表的指针偏转,此时B极电极反应式为 。
![]()
![]()
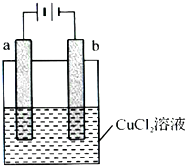 (2013?广州模拟)某小组为研究电化学原理,设计如下图装置,下列叙述中正确的是( )
(2013?广州模拟)某小组为研究电化学原理,设计如下图装置,下列叙述中正确的是( ) 为测定含有Na2O杂质的Na2O2样品的纯度,甲、乙二位同学设计了二种不同的实验方案.
为测定含有Na2O杂质的Na2O2样品的纯度,甲、乙二位同学设计了二种不同的实验方案.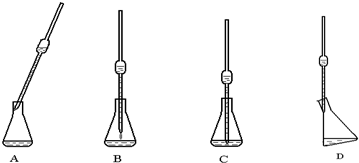
| 滴定次数 | 第一次滴定 | 第二次滴定 | 第三次滴定 |
| 消耗标准盐酸的体积(mL) | 24.98 | 25.00 | 25.02 |
(11分)为测定含有Na2O杂质的Na2O2样品的纯度,甲、乙二位同学设计了二种不同的实验方案。
已知:2Na2O2+2CO2===2Na2CO3+O2 2Na2O2+2H2O=== 4NaOH+O2
甲:用图l所示装置,通过测定Na2O2与CO2反应生成O2的体积来测定样品的纯度。
(1)C中所盛的药品是: 。
(2)A中橡皮管的作用是: 。
(3)利用该实验方案所测Na2O2的纯度明显偏大,其原因可能是 (填选项字母)。
a.装置A、B中的空气对测定结果产生了影响
b.装置C中的空气对测定结果产生了影响
c.读数时U形量气管中的液面左高右低
d.读数时U形量气管中的液面左低右高
乙:称取3.500 g试样,配成1000.00 mL溶液,用0.1000 mol·L-1的标准盐酸滴定。
(4)取上述所配溶液25.00 mL于锥形瓶中,操作如下图所示(手持部分省略):正确的操作是图 ,取溶液所用仪器的名称是 。

(5)滴定操作平行实验的数据记录如下表:
| 滴定次数 | 第一次滴定 | 第二次滴定 | 第三次滴定 |
| 消耗标准盐酸的体积(mL) | 24.98 | 25.00 | 25.02 |
由表中数据计算样品中Na2O2纯度为 。
海底蕴藏着大量的“可燃冰”。用甲烷制水煤气(CO、H2),再合成甲醇来代替日益供应紧张的燃油。
已知:① CH4(g)+H2O (g)=CO (g)+3H2 (g) △H1=+206.2kJ·mol-1
② CH4(g)+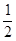 O2(g)=CO(g)+2H2(g)
△H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g)
△H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2 (g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为 。
(2)从原料、能源利用的角度,分析反应②作为合成甲醇更适宜方法的原因是 。
(3)水煤气中的H2可用于生产NH3,在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是: [Cu(NH3)2]Ac
+ CO + NH3  [Cu(NH3)3]Ac·CO
△H<0
[Cu(NH3)3]Ac·CO
△H<0
[Cu(NH3)2]Ac溶液吸收CO的适宜生产条件应是 。
(4)将CH4设计成燃料电池,其利用率更高,装置示意如下图(A、B为多孔性石墨棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。0<V≤44.8 L时,电池总反应方程式为 。
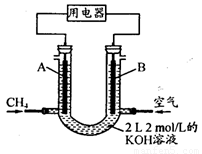
② 44.8 L<V≤89.6 L时,负极电极反应为 。
③ V=67.2 L时,溶液中离子浓度大小关系为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com