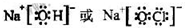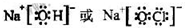(2009?清远模拟)传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高.DIS数字化信息系统(由传感器、数据采集器和计算机组成)因为可以准确测量溶液的pH等而在中和滴定的研究中应用越来越广泛深入.
(1)某学习小组利用DIS系统探究强碱和不同酸的中和反应,实验过程如下:
①分别配制0.1000mol/L的NaOH、HCl、CH
3COOH溶液备用.
②用0.1000mol/L的NaOH溶液分别滴定10.00mL0.1000mol/L的HCl和CH
3COOH溶液,连接数据采集器和pH传感器.
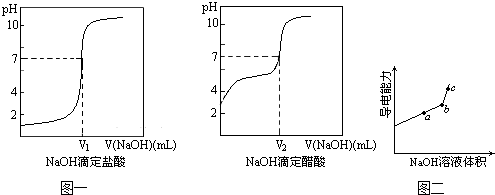
③由计算机绘制的滴定曲线如图一:
两曲线图起点不同的原因是
CH3COOH不完全电离,HCl完全电离,使0.1mol/L的CH3COOH溶液中c(H+)比同浓度的HCl溶液中c(H+)小,pH大
CH3COOH不完全电离,HCl完全电离,使0.1mol/L的CH3COOH溶液中c(H+)比同浓度的HCl溶液中c(H+)小,pH大
;两曲线图中V
1>
>
V
2 (填“>”、“=”或“<”)
(2)另一个学习小组利用DIS系统测定某醋酸溶液的物质的量浓度,以测量溶液导电能力来判断滴定终点,实验步骤如下:
①用
酸式滴定管
酸式滴定管
(填仪器名称)量取20.00mL醋酸溶液样品,倒入洁净干燥锥形瓶中,连接好DIS系统.如果锥形瓶中含有少蒸馏水,是否会影响测量结果
否
否
(填“是”、“否”、“不能确定”).向锥形瓶中滴加0.1000mol/L的NaOH溶液,计算机屏幕上显示出溶液导电能力与加入NaOH溶液体积关系的曲线图(见图二).
②醋酸与NaOH溶液反应的离子方程式为
CH3COOH+OH-=CH3COO-+H2O
CH3COOH+OH-=CH3COO-+H2O
.
③图中b点时,溶液中各离子浓度大小的关系是
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
.
④若图中某一点pH等于8,则c(Na
+)-c(CH
3COO
-)的精确值为
9.9×10-7
9.9×10-7
mol/L.