
题目列表(包括答案和解析)
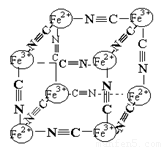
分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:[MxFey(CN)z],研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子晶胞结构如图示,下列说法正确的是 ( )
A.该晶体属于原子晶体
B.该晶体的化学式为M [Fe2(CN)6] 或M[FeFe(CN)6]
C.M的离子位于上述立方体的体内,呈+1价
D.该晶体属于离子化合物,M呈+2价
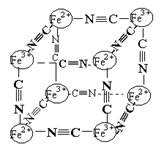
分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:[MxFey(CN)z],研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子晶胞结构如图示,下列说法正确的是 ( )
A.该晶体属于原子晶体
B.该晶体的化学式为M [Fe2(CN)6] 或M [FeFe(CN)6]
C.M的离子位于上述立方体的体内,呈+1价
D.该晶体属于离子化合物,M呈+2价
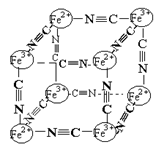
| A.该晶体属于原子晶体 |
| B.该晶体的化学式为M [Fe2(CN)6] 或M [FeFe(CN)6] |
| C.M的离子位于上述立方体的体内,呈+1价 |
| D.该晶体属于离子化合物,M呈+2价 |
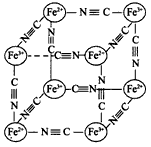
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com