
题目列表(包括答案和解析)
| ||
| ||
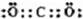
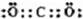
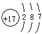
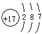
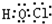
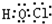
(1)D在元素周期表中的位置是____________。
(2)E离子的结构示意图为____________。
(3)C2的电子式为____________,在E2D2中含有的化学键类型有____________。
(4)由A、B、C、D四种元素组成的离子化合物的化学式为(写出一种即可)____________。
A、B、C、D、E均为短周期元素。A、B、C位于同一周期相邻位置,它们分别与D形成的分子中都有10个电子,且A和C的原子序数之比为3:4。E原子从内到外各电子层的电子数之比为1:4:1。则下列叙述正确的是( )
A.由A和C形成的一种化合物能与E的单质在一定条件下发生置换反应
B.由A,C原子和B、D原子分别构成的分子电子数相等
C.B、D两种单质相互化合的反应是不可逆反应
D.由A、B、C、D四种元素形成的化合物一定不属于无机盐
A、B、C、D、E均为短周期元素,其化合价与原子序数的关系如下图所示。
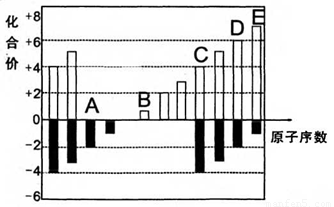
(1)A、B、C、D四种元素中第一电离能最小的是 (填元素名称),其基态原子核外电子排布式是 ,
(2)D、E的最高价氧化物的水化物中,酸性较强的是 (写化学式)。
D的氢化物沸点比A的氢化物沸点 (填“高”或“低”)。
(3)化合物CA2的晶体类型是______,CA2与B最髙价氧化物的水化物溶液发生反应的离子方程式是_______
(4)在298K、101.3kPa下,1.6gD单质在足量的氧气中燃烧,放出14.85kJ热量, 该反应的热化学方程式是______________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com