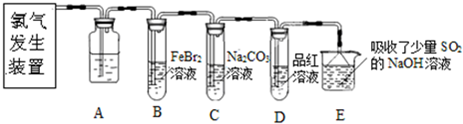
(2013?闸北区二模)氯气是一种重要的化工原料.某学习小组在实验室中利用如图所示装置制取氯气并探究其性质.
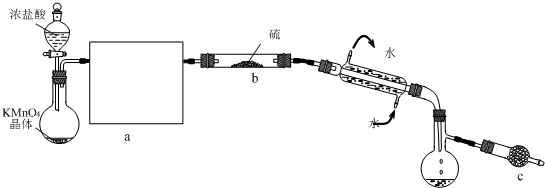
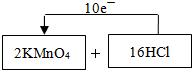
(1)实验室用二氧化锰和浓盐酸加热制取氯气,发生装置中除圆底烧瓶和导管外还需用到的玻璃仪器有
分液漏斗、酒精灯
分液漏斗、酒精灯
;
(2)装置A中盛有的试剂是
饱和食盐水
饱和食盐水
,作用是
除去氯气中的氯化氢
除去氯气中的氯化氢
.
(3)若D中品红溶液褪色,则B装置中发生反应的离子方程式是
2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2
2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2
(4)证明FeBr
2与Cl
2发生了氧化还原反应的实验方法是
实验后,取少量B中溶液,滴加KSCN溶液;另取少量B中溶液,加入CCl4溶液萃取
实验后,取少量B中溶液,滴加KSCN溶液;另取少量B中溶液,加入CCl4溶液萃取
(填操作方法).
某研究性学习小组用刚吸收过少量SO
2的NaOH溶液吸收处理上述实验后的尾气.经分析吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl
-、OH
-、CO
32-和SO
42-,对于可能存在的其他阴离子,研究小组提出以下3种假设.假设1:只存在SO
32-;假设2:只存在ClO
-;假设3:既不存在SO
32-,也不存在ClO
-.
(5)学习小组判断同时存在SO
32-和ClO
-是不可能的理由是
SO32-和ClO-因发生氧化还原反应,故不能共存
SO32-和ClO-因发生氧化还原反应,故不能共存
.
(6)现限选以下试剂,设计实验方案,进行实验,请写出实验步骤以及预期现象和结论.
a.3mol/L H
2SO
4 b.0.01mol/L KMnO
4c.1mol/L BaCl
2溶液
d.淀粉碘化钾溶液 e.酚酞试液
步骤一;取少量吸收液于试管中,滴加3mol/L H
2SO
4至溶液呈酸性,然后将所得溶液分装于A、B两试管中.
步骤二:向A试管中滴加少量
b
b
(填序号),若溶液
褪色
褪色
(填现象),则假设1成立.
步骤三:向B试管中滴加少量
d
d
(填序号),若溶液
变蓝色
变蓝色
(填现象),则假设2成立.