
题目列表(包括答案和解析)
(12分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)  CH3OH(g),不同温度时甲醇的物质的量随时间变化曲线如下图所示。根据题意完成下列各题:
CH3OH(g),不同温度时甲醇的物质的量随时间变化曲线如下图所示。根据题意完成下列各题:
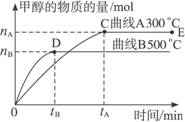
(1)反应达到平衡时,升高温度,v正_____________ (填“增大”“减小”或“不变”)。化学平衡向 移动
(2)500 ℃,从反应开始到平衡,H2的反应速率v(H2)=________________________。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是_____________。
A.氢气的浓度减小 B.正反应速率加快,逆反应速率也加快
C.甲醇的物质的量增加 D.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是__________________________(用化学方程式表示)。
(12分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g),不同温度时甲醇的物质的量随时间变化曲线如下图所示。根据题意完成下列各题:
(1)反应达到平衡时,升高温度,v正_____________ (填“增大”“减小”或“不变”)。化学平衡向 移动
(2)500 ℃,从反应开始到平衡,H2的反应速率v(H2)=________________________。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是_____________。
A.氢气的浓度减小 B.正反应速率加快,逆反应速率也加快
C.甲醇的物质的量增加 D.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是__________________________(用化学方程式表示)。
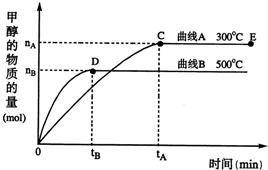 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO): CH3OH(g)
CH3OH(g)| c(CH3OH) |
| c(CO)?c2(H2) |
| c(CH3OH) |
| c(CO)?c2(H2) |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
| 1 |
| 2 |
| n(H2) |
| n(CH3OH) |
 2Cu+CO2
2Cu+CO2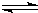 2Cu+CO2
2Cu+CO2| 点燃 |
| 点燃 |

| 化合物 | A | B | C |
| w(X) | 0.077 9 | 0.237 6 | 0.75 |
| w(Y) | 0.922 1 | 0.703 | 0 |
| 常压下T℃时的密度(g/cm3) | 1.594 7(20℃) | 2.254 5×10-3(0℃) | 0.668×10-3(20℃) |
| 沸点/℃ | 76.8 | -23.7 | -161.49 |
| 熔点/℃ | -22.95 | -97 | -182.48 |
| n |
| Mr(X)+n |
| n |
| Mr(X)+n |
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).根据题意完成下列问题:
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).根据题意完成下列问题:| c(CH3OH) |
| c(CO)?C 2(H2) |
| c(CH3OH) |
| c(CO)?C 2(H2) |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
| 1 |
| 2 |
| n(H2) |
| n(CH3OH) |
 2Cu+CO2
2Cu+CO2 2Cu+CO2
2Cu+CO2湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com